题目内容
11. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
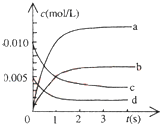
(2)如图中表示NO2的变化的曲线是b.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应K300℃>K350℃;25℃时,生成1mol NO2,热量变化为56.4kJ.但是该同学由于疏忽,忘记注明“+”、“-”.根据题目信息,该反应的热化学方程式为2NO(g)+O2(g)?2NO2(g)△H=-112.8KJ/mol.
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
分析 (1)平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(2)根据表格知,随着反应的进行,一氧化氮的物质的量减小,则平衡向正反应方向移动,二氧化氮的物质的量逐渐增大,根据一氧化氮和二氧化氮之间转化关系式计算平衡时二氧化氮的物质的量,从而确定曲线;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)25℃时,生成1mol NO2,热量变化为56.4kJ,则生成2mol NO2,热量变化为112.8kJ,据此写出热化学方程式;
(5)根据化学反应速率的影响因素和化学平衡移动影响因素判断.
解答 解:(1)2NO(g)+O2(g)?2NO2(g)体系中达到平衡状态,平衡常数K=$\frac{[N{O}_{2}]^{2}}{[NO]^{2}[{O}_{2}]}$,故答案为:$\frac{[N{O}_{2}]^{2}}{[NO]^{2}[{O}_{2}]}$;
(2)根据表格知,随着反应的进行,一氧化氮的物质的量减小,则平衡向正反应方向移动,二氧化氮的物质的量逐渐增大,当反应达到平衡状态时,参加反应的n(NO)=(0.020-0.007)mol=0.013mol,根据二氧化氮和一氧化氮的关系式知,平衡状态时生成n(NO2)等于参加反应的n(NO),所以为0.013mol,c(NO2)=$\frac{0.013mol}{2L}$=0.0065mol/L,故选b,
故答案为:b;
(3)a、反应速率之比等于化学方程式计量数之比,为正反应速率之比,当v (NO2)=2v (O2)时,该反应不一定达到平衡状态,故a错误;
b、该反应是一个反应气体气体体积改变的可逆反应,当达到平衡状态时,各物质的浓度不变,则容器内压强保持不变,故b正确;
c、不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v逆(NO)=2v正(O2),说明到达平衡,故c正确;
d、根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以不能据此判断是否达到平衡状态,故d错误;
故选bc,故答案为:bc;
(4)25℃时,生成1mol NO2,热量变化为56.4kJ,则生成2mol NO2,热量变化为112.8kJ,据此写出热化学方程式为:2NO(g)+O2(g)?2NO2(g)△H=-112.8KJ/mol,故答案为:2NO(g)+O2(g)?2NO2(g)△H=-112.8KJ/mol;
(5)a.及时分离除NO2气体,浓度降低,化学反应速率减小,故a错误;
b.正反应为放热反应,升高温度,化学平衡向逆反应方向移动,故b错误;
c.增大O2的浓度,增大反应速率,且化学平衡向正反应方向移动,故c正确;
d.选择高效催化剂,只增大化学反应速率,不影响化学平衡移动,故d错误;
故选c.
点评 本题考查平衡常数即影响因素、化学反应速率、影响化学平衡的元素与平衡状态的判断等,难度中等,注意平衡状态判断选择判断的物理量,应随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 纯碱、烧碱均属碱 | B. | C02、SO2均属酸性氧化物 | ||
| C. | 凡能电离出H+的化合物均属酸 | D. | 盐类物质一定含有金属离子 |
| A. | 100mL 2mol/L MgCl2溶液 | B. | 1000mL 2.5 mol/L NaCl溶液 | ||
| C. | 250mL l mol/L AlCl3溶液 | D. | 300mL 3 mol/LKCl溶液 |
| A. | 溶质为NaHCO3 | |
| B. | 溶质为Na2CO3 | |
| C. | 增重的4.4g为参加反应的CO2的质量 | |
| D. | 低温蒸干溶液,所得固体的质量为:(原溶液中NaOH的质量+4.4g) |
| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 钠和水反应,每转移0.2NA个电子,生成2.24L氢气 | |
| C. | 18g D2O中含有氧原子的数目为NA个 | |
| D. | 将0.1 mol的Na2CO3溶于水配成1升溶液,其阴离子数目大于0.1NA |