题目内容
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 钠和水反应,每转移0.2NA个电子,生成2.24L氢气 | |
| C. | 18g D2O中含有氧原子的数目为NA个 | |
| D. | 将0.1 mol的Na2CO3溶于水配成1升溶液,其阴离子数目大于0.1NA |
分析 A.氢氧化钡溶液中,氢氧化钡和水都能电离产生氢氧根离子;
B.气体状况未知;
C.18g D2O物质的量为$\frac{18g}{20g/mol}$=0.9mol,结合1个D2O含有2个D解答;
D.碳酸根离子水解生成碳酸氢根离子和氢氧根离子.
解答 解:A.氢氧化钡溶液中,氢氧化钡和水都能电离产生氢氧根离子,所以25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目大于0.2NA,故A错误;
B.钠和水反应,每转移0.2NA个电子,生成0.1mol氢气,气体状况未知,无法计算体积,故B错误;
C.1个D2O含有2个D,18g D2O物质的量为$\frac{18g}{20g/mol}$=0.9mol,含有氧原子的数目为1.8NA个,故C错误;
D.碳酸根离子水解生成碳酸氢根离子和氢氧根离子,0.1 mol的Na2CO3溶于水配成1升溶液,其阴离子数目大于0.1NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的应用和计算,熟练掌握公式和物质的组成和结构是关键,注意碳酸根离子的水解,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.在托盘天平右盘上放一个盛有100mL3mol•L-1NaOH溶液的烧杯,左盘上放一个盛有100mL3mol•L-1盐酸的烧杯,调节天平至平衡,然后在两烧杯中各加入等质量2.7g的铝片,反应完全后,则天平可能出现的情况是( )
| A. | 左盘上升 | B. | 右盘下沉 | C. | 仍保持平衡 | D. | 无法判断 |
11.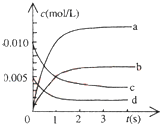 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{[N{O}_{2}]^{2}}{[NO]^{2}[{O}_{2}]}$.
(2)如图中表示NO2的变化的曲线是b.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应K300℃>K350℃;25℃时,生成1mol NO2,热量变化为56.4kJ.但是该同学由于疏忽,忘记注明“+”、“-”.根据题目信息,该反应的热化学方程式为2NO(g)+O2(g)?2NO2(g)△H=-112.8KJ/mol.
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应K300℃>K350℃;25℃时,生成1mol NO2,热量变化为56.4kJ.但是该同学由于疏忽,忘记注明“+”、“-”.根据题目信息,该反应的热化学方程式为2NO(g)+O2(g)?2NO2(g)△H=-112.8KJ/mol.
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
8.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2与盐酸 Cu(OH)2与醋酸 | |
| B. | BaCl2溶液与Na2SO4溶液 Ba(OH)2溶液与Na2SO4溶液 | |
| C. | NaHCO3溶液与NaHSO4溶液 Na2CO3溶液与NaHSO4溶液 | |
| D. | 石灰石与硝酸 生石灰与盐酸 |
12.下列物质中,含有共价键的离子化合物是( )
| A. | NH3 | B. | H2 | C. | NaOH | D. | H2SO4 |
6.下列说法中,错误的是( )
| A. | 有机物 CH4 和CH3OH,不论以何种比例混合,混合物完全燃烧后,产生的水和二氧化碳的分子数比为2:1 | |
| B. | 为了除去甲烷中含有的少量乙烯气体,将混合气体通过酸性高锰酸钾溶液中洗气,可以得到纯净的甲烷气体 | |
| C. | 将a g CH2O、H2以及CO的混合气体在氧气中完全燃烧的产物,通过足量的过氧化钠固体,充分反应后,固体增重也是a g | |
| D. | 实验室制取乙炔时,可将生成的气体通过硫酸铜溶液,除去可能存在的H2S等气体 |



