题目内容
1.铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液,则在Cl2、Cl-、H+中,具有氧化性的是Cl2、H+其中氧化性强的是Cl2.分析 当微粒处于元素的最高价态时,微粒只有氧化性,当处于中间价态时,既有氧化性又有还原性,当处于最低价态时,只有还原性.根据元素的化合价和物质的性质分析.
解答 解:在Cl2、Cl-、H+中,H+处于氢元素的最高价态,具有氧化性;氯气处于氯元素的中间价态,容易得电子具有较强的氧化性;Cl-处于氯元素的最低价态,只有还原性,无氧化性;故具有氧化性的是Cl2、H+;而氯气能将铁氧化为+3价,但氢离子只能将铁氧化为+2价,故氯气的氧化性强于氢离子,故其中氧化性最强的是Cl2,
故答案为:Cl2、H+;Cl2.
点评 本题考查氧化性的强弱比较,题目难度不大,注意从化合价的角度和反应后元素的价态来分析.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
11.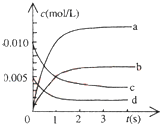 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{[N{O}_{2}]^{2}}{[NO]^{2}[{O}_{2}]}$.
(2)如图中表示NO2的变化的曲线是b.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应K300℃>K350℃;25℃时,生成1mol NO2,热量变化为56.4kJ.但是该同学由于疏忽,忘记注明“+”、“-”.根据题目信息,该反应的热化学方程式为2NO(g)+O2(g)?2NO2(g)△H=-112.8KJ/mol.
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应K300℃>K350℃;25℃时,生成1mol NO2,热量变化为56.4kJ.但是该同学由于疏忽,忘记注明“+”、“-”.根据题目信息,该反应的热化学方程式为2NO(g)+O2(g)?2NO2(g)△H=-112.8KJ/mol.
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
12.下列物质中,含有共价键的离子化合物是( )
| A. | NH3 | B. | H2 | C. | NaOH | D. | H2SO4 |
16.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,33.6L 氯气与27g铝充分反应,转移的电子数目为3NA | |
| B. | 1mol羟基中含有10NA | |
| C. | 1molCH3COONa和少量CH3COOH溶于水所得的中性溶液中,CH3COO-的数目为NA | |
| D. | 1mol O2作氧化剂时转移的电子数目一定为4NA |
6.下列说法中,错误的是( )
| A. | 有机物 CH4 和CH3OH,不论以何种比例混合,混合物完全燃烧后,产生的水和二氧化碳的分子数比为2:1 | |
| B. | 为了除去甲烷中含有的少量乙烯气体,将混合气体通过酸性高锰酸钾溶液中洗气,可以得到纯净的甲烷气体 | |
| C. | 将a g CH2O、H2以及CO的混合气体在氧气中完全燃烧的产物,通过足量的过氧化钠固体,充分反应后,固体增重也是a g | |
| D. | 实验室制取乙炔时,可将生成的气体通过硫酸铜溶液,除去可能存在的H2S等气体 |
3.CO2通入下列溶液中,不可能产生沉淀的是( )
| A. | 氯化钙溶液 | B. | 澄清石灰水 | C. | 饱和碳酸钠溶液 | D. | 次氯酸钙溶液 |