题目内容
20. 已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)(1)A、B、C的电负性大小顺序为C<N<O;一种由B、C三种元素组成的粒子与AC2互为等电子体,其化学式为N2O.
(2)E的价层电子排布式是1s22s22p63s23p63d54s1,ECl3与B、C的氢化物形成的配合物M的化学式为[Cr(NH3)4(H2O)2]Cl3,1molM的配离子中σ键的个数为20NA.
(3).化合物N可视为两个B的氢化物分子各脱去一个氢原子后B原子间再成键的另一种B的氢化物.
①B的氢化物分子立体构型是三角锥形,该分子中B原子的杂化类型为sp3.
②B的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高的可能原因是氨气分子之间存在氢键.
③N能与硫酸反应生成B2H6SO4.B2H6SO4晶体类型与(BH4)2SO4相同,则B2H6SO4的晶体内不存在d(填标号).
a.离子键 b.共价键 c.配位键 d.范德华力
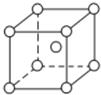
(4)D的立方晶胞如图所示,则每个D原子最近且距离相等的D原子个数为8,若D原子半径为acm,则该晶体的密度为$\frac{9\sqrt{3}}{4{N}_{A}{r}^{3}}$g/cm3(已知:用含a、NA的代数式表示).
分析 A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,C形成-2价阴离子,且D位于C的下一周期;B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,分子中存在氢键,C形成-2价阴离子,则C为氧元素,D为镁元素,核电荷数B<C,则B为氮元素;其中A、B、C是同一周期的非金属元素,AC2为非极性分子,则A为碳元素;E的原子序数为24,则E为Cr元素;CrCl3能与NH3、H2O形成六配位的配合物,且两种配体的物质的量之比为2:1,则配体中有4个NH3、2个H2O,三个氯离子位于外界,该配合物为[Cr(NH3)4(H2O)2]Cl3.以此解答该题.
解答 解:A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,C形成-2价阴离子,且D位于C的下一周期;B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,分子中存在氢键,C形成-2价阴离子,则C为氧元素,D为镁元素,核电荷数B<C,则B为氮元素;其中A、B、C是同一周期的非金属元素,AC2为非极性分子,则A为碳元素;E的原子序数为24,则E为Cr元素;CrCl3能与NH3、H2O形成六配位的配合物,且两种配体的物质的量之比为2:1,则配体中有4个NH3、2个H2O,三个氯离子位于外界,该配合物为[Cr(NH3)4(H2O)2]Cl3.
(1)A、B、C分别为C、N、O,位于周期表相同周期,电负性依次增大,为C<N<O,化合物AC2是CO2,一种由N元素、O元素化合物与CO2互为等电子体,其化学式为N2O,
故答案为:C<N<O;N2O;
(2)E为Cr元素,原子序数为24,原子核外有24个电子,核外电子排布式是 1s22s22p63s23p63d54s1;CrCl3能与NH3、H2O形成六配位的配合物,且两种配体的物质的量之比为2:1,则配体中有4个NH3、2个H2O,三个氯离子位于外界,该配合物为[Cr(NH3)4(H2O)2]Cl3.M的配离子中Cr-N、N-H、O-H键为σ键,共20个,则1mol含有20NA个,
故答案为:1s22s22p63s23p63d54s1;[Cr(NH3)4(H2O)2]Cl3;20NA;
(3)①B为N元素,形成的氢化物为NH3,分子中含有3个σ键,1个孤电子对,为sp3杂化,为三角锥形结构,
故答案为:三角锥形;sp3;
②氨气分子之间存在氢键,沸点比它们同族相邻周期元素氢化物的高,
故答案为:氨气分子之间存在氢键;
③硫酸铵是离子化合物,硫酸铵中存在离子键和共价键,N2H6SO4晶体类型与硫酸铵相同,所以N2H6SO4的晶体内存在离子键、共价键和配位键,不含范德华力,
故答案为:d;
(4)每个D原子最近且距离相等的D原子个数位于定点和体心,则每个定点为8个晶胞共有,则每个D原子最近且距离相等的D原子个数为8,晶胞中Mg的个数为1+8×$\frac{1}{8}$=2,则晶胞的质量为$\frac{2×24}{{N}_{A}}$.设边长为x,则($\sqrt{2}$x)2+x2=(4r)2,x=$\frac{4}{\sqrt{3}}$r,所以晶胞的体积为($\frac{4}{\sqrt{3}}$r)3,则该晶体的密度为$\frac{\frac{48}{{N}_{A}}}{(\frac{4}{\sqrt{3}}r)^{3}}$=$\frac{9\sqrt{3}}{4{N}_{A}{r}^{3}}$(g/cm3).
故答案为:8;$\frac{9\sqrt{3}}{4{N}_{A}{r}^{3}}$.
点评 本题考查位置、结构与性质关系的综合应用,为高考常见题型,题目难度中等,试题综合性较大,涉及结构性质越位置关系、元素周期律、电子式与核外电子排布、配合物与杂化理论、分子结构,氧化还原反应等知识,是物质结构的综合性题目,是对学生综合能力的考查,氢化物的沸点比它们同族相邻周期元素氢化物的沸点高是推断的突破口.

| A. | 7.8 g Na2O2中所含阴离子的数目是0.2NA | |
| B. | 标准状况下,22.4 L SO3含分子数为NA | |
| C. | 标准状况下,2.24 L 18O2中所含中子的数目是2NA | |
| D. | 用足量NaOH溶液完全吸收1 mol Cl2时,转移电子的数目是2NA |
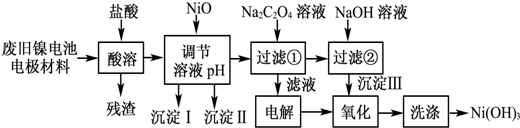
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
(1)用NiO调节溶液的pH,依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3(填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸.
(4)写出“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(5)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.
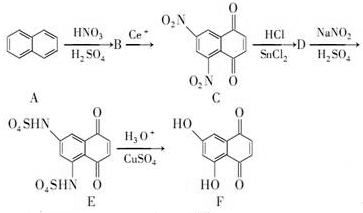
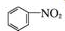 +SnCl2$\stackrel{HCl}{→}$
+SnCl2$\stackrel{HCl}{→}$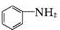 +SnCl4
+SnCl4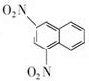 .
.
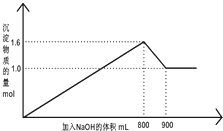 向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:
向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题: