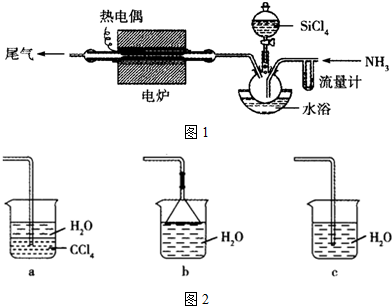
题目内容
17.光纤通信是一种现代化的通信手段,制造光导纤维的主要原料是SiO2,下列关于SiO2的说法正确的是( )| A. | SiO2的摩尔质量是60 | |
| B. | 1mol SiO2中含有1mol O2 | |
| C. | 1.5mol SiO2中含有1.806×1024个氧原子 | |
| D. | 1mol SiO2的质量是60g•mol-1 |
分析 A、摩尔质量的单位是g/mol;
B、二氧化硅是由硅原子和氧原子构成的;
C、1mol二氧化硅是由1mol硅原子和2mol氧原子构成的;
D、质量的单位是克.
解答 解:A、SiO2的摩尔质量是60g/mol,摩尔质量的单位是g/mol,故A错误;
B、二氧化硅是由硅原子和氧原子构成的,其中没有氧气分子,故B错误;
C、1mol二氧化硅是由1mol硅原子和2mol氧原子构成的,所以1.5molSiO2中含有3mol即1.806×1024个氧原子,故C正确;
D、1mol SiO2的质量是60g,故D错误.
故选C.
点评 本题考查学生二氧化硅的构成和性质,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
7.一包NH4Cl化肥中混入少量其他氮肥,可能是NH4NO3或(NH4)2SO4中的一种,经测定知样品中含氮量为25.7%.这包化肥中氯化铵的质量分数为( )
| A. | 80% | B. | 85% | C. | 90% | D. | 95% |
12.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害.某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
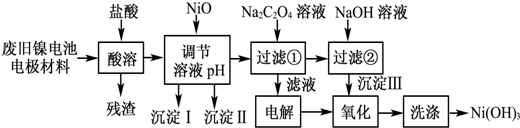
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
回答下列问题:
(1)用NiO调节溶液的pH,依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3(填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸.
(4)写出“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(5)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
(1)用NiO调节溶液的pH,依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3(填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸.
(4)写出“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(5)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.
2.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 25℃时,0.1mol/L pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | NaHCO3溶液:c(OH-)=c(H+)+c(H2CO3-)-c(CO32-) | |
| C. | 25℃时,pH=9、浓度均为0.1 mol/L的NH3•H2O、NH4Cl混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
2.下列有关共价化合物的说法中,一定正确的是( )
①具有较低的熔、沸点
②不是电解质
③固体时是分子晶体
④都由分子构成
⑤液态时不导电.
①具有较低的熔、沸点
②不是电解质
③固体时是分子晶体
④都由分子构成
⑤液态时不导电.
| A. | ①③④ | B. | ②④⑤ | C. | ①②③④⑤ | D. | 只有⑤ |
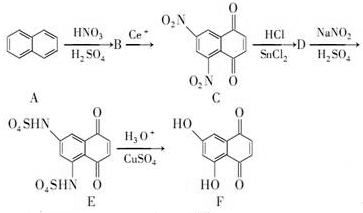
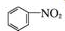 +SnCl2$\stackrel{HCl}{→}$
+SnCl2$\stackrel{HCl}{→}$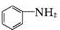 +SnCl4
+SnCl4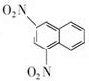 .
.