题目内容
一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
| A、达到平衡时X浓度为0.04 mol/L |
| B、将容器体积变为20L,Z的平衡浓度变为0.015mol/L |
| C、若增大压强,平衡向正反应方向移动,平衡常数变大 |
| D、若升高温度,X的体积分数增大,则该反应的△H<0 |
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:A、根据生成的Z的量求出转化的X的量,再求出平衡时X的浓度;
B、由于前后气体计量数之和不相等,容积增大,压强减小,化学平衡向逆反应方向移动;
C、平衡常数只随温度的变化而变化;
D、升高温度化学平衡向吸热的方向移动.
B、由于前后气体计量数之和不相等,容积增大,压强减小,化学平衡向逆反应方向移动;
C、平衡常数只随温度的变化而变化;
D、升高温度化学平衡向吸热的方向移动.
解答:
解:A、经60s达到平衡,生成0.3mol Z,则消耗的X为0.6mol,所以达到平衡时X浓度为
=0.04 mol/L,故A正确;
B、容积增大为20L,压强减小为原来的一半,如果平衡不移动则Z浓度变为原来的
,但是压强减小时,平衡向左移动,Z浓度小于原来的
,即Z的平衡浓度小于0.015mol/L,故B错;
C、平衡常数只随温度的变化而变化,所以若增大压强,则平衡常数不变,故C错误;
D、若升高温度,X的体积分数增大,说明向逆反应方向移动,故逆反应吸热,则正反应方向为放热,故△H<0,故D正确.
故答案为:AD.
| (1-0.6)mol |
| 10L |
B、容积增大为20L,压强减小为原来的一半,如果平衡不移动则Z浓度变为原来的
| 1 |
| 2 |
| 1 |
| 2 |
C、平衡常数只随温度的变化而变化,所以若增大压强,则平衡常数不变,故C错误;
D、若升高温度,X的体积分数增大,说明向逆反应方向移动,故逆反应吸热,则正反应方向为放热,故△H<0,故D正确.
故答案为:AD.
点评:本题主要考查化学平衡移动的影响因素,根据反应物浓度、压强、温度等因素对平衡移动的影响,可以做出准确的判断,题目难度中等.

练习册系列答案
相关题目
下列物质转化需要加入还原剂才能实现的是( )
| A、CuO→Cu |
| B、Fe2+→Fe3+ |
| C、NaOH→NaCl |
| D、KClO3→KCl |
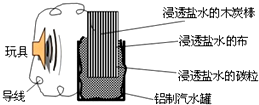 利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置,如图就是用一个废旧材料制作的可用于驱动玩具电池的示意图.该电池工作时有关说法正确的是( )
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置,如图就是用一个废旧材料制作的可用于驱动玩具电池的示意图.该电池工作时有关说法正确的是( )| A、铝罐将逐渐被腐蚀 |
| B、该装置实现了化学能向电能的转化 |
| C、炭棒应与玩具电机的负极相连 |
| D、该电池工作一段时间后炭棒和炭粒的质量会减轻 |
下列基态原子的电子构型中,正确的是( )
| A、3d94s2 |
| B、3d44s2 |
| C、3d104s0 |
| D、3d83s2 |
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与上述反应在氧化还原原理上最相似的反应是( )
| A、2NaBr+Cl2═2NaCl+Br2 | ||||
B、2KMnO4
| ||||
| C、2H2S+SO2═3S↓+2H2O | ||||
| D、2FeCl3+H2S═2FeCl2+S↓+2HCl |
某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2,下列说法中正确的是( )
| 充电 |
| 放电 |
| A、放电时,负极上发生反应的物质是NiO2 |
| B、放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 |
| C、充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O |
| D、充电时,阳极附近pH值减小 |
下列说法正确的是( )
| A、在100℃、101kPa条件下,液态水的气化热为40.69kJ?mol-1,则H2O(g)?H2O(l)的△H=40.69kJ?mol-1 |
| B、在PH=2的盐酸中,水电离出来的c(OH-)=1.0×10-12mol?L-1 |
| C、CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)的△H=2×(-283.0)kJ?mol-1 |
| D、常温下,在0.10mol?L-1的NH3?H2O溶液中加入少量NH4Cl晶体,能使NH3?H2O的电离度降低,溶液的pH减小 |
NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1molFe和足量浓硝酸反应后,转移电子数目为0.3NA |
| B、标准状况下,1 molHF分子体积约为22.4 L |
| C、1molCl2参加化学反应,一定转移2mol电子 |
| D、11g 2D218O中含有的氢氧键数目为NA |