题目内容
某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2,下列说法中正确的是( )
| 充电 |
| 放电 |
| A、放电时,负极上发生反应的物质是NiO2 |
| B、放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 |
| C、充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O |
| D、充电时,阳极附近pH值减小 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由总反应式Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2可知,根据原电池在放电时,负极发生氧化反应,正极发生还原反应,再根据元素化合价变化,可判断该电池负极发生反应的物质为Fe,正极为NiO2,此电池为碱性电池,在书写电极反应和总电池反应方程式时不能出现H+,故放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-.原电池充电时,发生电解反应,此时阴极反应为原电池负极反应的逆反应,阳极反应为原电池正极反应的逆反应.
| 充电 |
| 放电 |
解答:
解:A.放电时,Fe元素化合价升高,被氧化,应为原电池负极,故A错误;
B.此电池为碱性电池,反应方程式时不能出现H+,放电时,正极反应是NiO2+2e-+2H2O=Ni(OH)2+2OH-,故B错误;
C.充电时,阴极反应为原电池负极反应的逆反应,阴极反应是Fe(OH)2+2e-=Fe+2OH-,故C错误;
D.充电时,阳极反应为Ni(OH)2+2OH--2e-+=NiO2+2H2O,OH-浓度减小,则阳极附近pH值减小,故D正确;
故选D.
B.此电池为碱性电池,反应方程式时不能出现H+,放电时,正极反应是NiO2+2e-+2H2O=Ni(OH)2+2OH-,故B错误;
C.充电时,阴极反应为原电池负极反应的逆反应,阴极反应是Fe(OH)2+2e-=Fe+2OH-,故C错误;
D.充电时,阳极反应为Ni(OH)2+2OH--2e-+=NiO2+2H2O,OH-浓度减小,则阳极附近pH值减小,故D正确;
故选D.
点评:本题考查原电池和电解池的工作原理,题目难度中等,注意电解反应式的书写,为解答该题的关键,答题时注意体会.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对可逆反应:N2+3H2?2NH3达平衡时,若分别增大压强和降低压强,两种情况下对平衡体系正逆反应速率影响较大的依次是( )
| A、正反应速率,正反应速率 |
| B、逆反应速率,逆反应速率 |
| C、正反应速率,逆反应速率 |
| D、逆反应速率,正反应速率 |
已知:11P4(白磷)+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4,若有9 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
某有机物的结构简式为 .该有机物水解后的生成物分别能与金属钠、氢氧化钠、新制氢氧化铜发生反应,从理论上可以算出1mol生成物分别与上述三种无机物反应所消耗的物质的量的比为( )
.该有机物水解后的生成物分别能与金属钠、氢氧化钠、新制氢氧化铜发生反应,从理论上可以算出1mol生成物分别与上述三种无机物反应所消耗的物质的量的比为( )
 .该有机物水解后的生成物分别能与金属钠、氢氧化钠、新制氢氧化铜发生反应,从理论上可以算出1mol生成物分别与上述三种无机物反应所消耗的物质的量的比为( )
.该有机物水解后的生成物分别能与金属钠、氢氧化钠、新制氢氧化铜发生反应,从理论上可以算出1mol生成物分别与上述三种无机物反应所消耗的物质的量的比为( )| A、1:1:1 |
| B、3:2:2 |
| C、3:2:3 |
| D、6:4:5 |
一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
| A、达到平衡时X浓度为0.04 mol/L |
| B、将容器体积变为20L,Z的平衡浓度变为0.015mol/L |
| C、若增大压强,平衡向正反应方向移动,平衡常数变大 |
| D、若升高温度,X的体积分数增大,则该反应的△H<0 |
在容积不变的密闭容器中存在反应:2A(g)+B(g)
2C(g)△H<0;某研究小组研究了只改变某一反应条件对上述反应的影响,下列说法正确的是( )
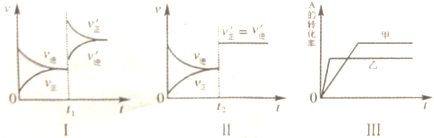
| 催化剂 |
| 加热 |

| A、图Ⅰ表示的是t1时刻增大B的浓度对反应速率的影响 |
| B、图Ⅱ表示的是t2时刻加入催化剂后对反应速率的影响 |
| C、图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
| D、图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
下列各组离子在溶液中可以大量共存的是( )
| A、H+.CO32-.NO3-.SO42- |
| B、Ba2+.Cl-.NO3-.CO32- |
| C、Cu2+.H+.SO42-.Cl- |
| D、Ag+.OH-.CO32-.H+ |
下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
| A、2F2+2H2O=4HF+O2 | ||||
| B、AgNO3+NaCl=AgCl↓+NaNO3 | ||||
C、3CO+Fe2O3
| ||||
D、MgCl2 (熔融)
|