题目内容
下列说法正确的是( )
| A、在100℃、101kPa条件下,液态水的气化热为40.69kJ?mol-1,则H2O(g)?H2O(l)的△H=40.69kJ?mol-1 |
| B、在PH=2的盐酸中,水电离出来的c(OH-)=1.0×10-12mol?L-1 |
| C、CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)的△H=2×(-283.0)kJ?mol-1 |
| D、常温下,在0.10mol?L-1的NH3?H2O溶液中加入少量NH4Cl晶体,能使NH3?H2O的电离度降低,溶液的pH减小 |
考点:热化学方程式,pH的简单计算
专题:化学反应中的能量变化,电离平衡与溶液的pH专题
分析:A、液态水的气化热为40.69kJ?mol-1,是液体水变化为气体需要吸收热量,焓变为负值;
B、温度不一定是常温,溶液中离子积常数不一定是10-14;
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式改变方向,焓变改变符号;
D、一水合氨是弱电解质存在电离平衡,加入氯化铵晶体,溶解后铵根离子浓度增大,抑制一水合氨的电离,氢氧根离子浓度减小;
B、温度不一定是常温,溶液中离子积常数不一定是10-14;
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式改变方向,焓变改变符号;
D、一水合氨是弱电解质存在电离平衡,加入氯化铵晶体,溶解后铵根离子浓度增大,抑制一水合氨的电离,氢氧根离子浓度减小;
解答:
解:A、液态水的气化热为40.69kJ?mol-1,是液体水变化为气体需要吸收热量,焓变为负值,故A错误;
B、温度不一定是常温,溶液中离子积常数不一定是10-14,在常温下,在PH=2的盐酸中,水电离出来的c(OH-)=1.0×10-12mol?L-1,故B错误;
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式改变方向,焓变改变符号,CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)的△H=2×283.0kJ?mol-1,故C错误;
D、一水合氨是弱电解质存在电离平衡,加入氯化铵晶体,溶解后铵根离子浓度增大,抑制一水合氨的电离,氢氧根离子浓度减小,能使NH3?H2O的电离度降低,溶液的pH减小,故D正确;
故选D.
B、温度不一定是常温,溶液中离子积常数不一定是10-14,在常温下,在PH=2的盐酸中,水电离出来的c(OH-)=1.0×10-12mol?L-1,故B错误;
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式改变方向,焓变改变符号,CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)的△H=2×283.0kJ?mol-1,故C错误;
D、一水合氨是弱电解质存在电离平衡,加入氯化铵晶体,溶解后铵根离子浓度增大,抑制一水合氨的电离,氢氧根离子浓度减小,能使NH3?H2O的电离度降低,溶液的pH减小,故D正确;
故选D.
点评:本题考查了汽化热、燃烧热概念分析,离子积常数的应用条件,若点击电离平衡影响因素分析和溶液酸碱性变化分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列各组物质的反应,能用H++OH-=H2O表示的是( )
| A、硫酸和氢氧化钡溶液 |
| B、盐酸和烧碱溶液 |
| C、硫酸和氢氧化铜 |
| D、盐酸和氢氧化铁 |
某气态烃0.5mol能与1mol氯化氢完全加成,加成后的产物分子上的氢原子最多可被3mol氯气取代,则此气态烃可能是( )
| A、CH2=CH2 |
| B、CH2=C(CH3)-CH3 |
| C、CH≡CH |
| D、CH≡C-CH3 |
一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
| A、达到平衡时X浓度为0.04 mol/L |
| B、将容器体积变为20L,Z的平衡浓度变为0.015mol/L |
| C、若增大压强,平衡向正反应方向移动,平衡常数变大 |
| D、若升高温度,X的体积分数增大,则该反应的△H<0 |
下列说法中正确的是( )
| A、某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+ |
| B、能使石蕊变红的溶液中可能含有Cl-、K+、Na+、NO3- |
| C、取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42- |
| D、H++OH-═H2O可描述所有酸碱中和反应的实质 |
下列各组离子在溶液中可以大量共存的是( )
| A、H+.CO32-.NO3-.SO42- |
| B、Ba2+.Cl-.NO3-.CO32- |
| C、Cu2+.H+.SO42-.Cl- |
| D、Ag+.OH-.CO32-.H+ |
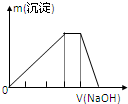 某盐A是含有两种阳离子的硫酸盐,将该溶液溶于水,向溶液中滴加NaOH溶液生成沉淀的物质的量与NaOH体积关系如图所示,下列离子溶液中能大量共存,加入晶体A后仍能大量共存的是( )
某盐A是含有两种阳离子的硫酸盐,将该溶液溶于水,向溶液中滴加NaOH溶液生成沉淀的物质的量与NaOH体积关系如图所示,下列离子溶液中能大量共存,加入晶体A后仍能大量共存的是( )| A、Na+、H+、Cl-、NO3- |
| B、K+、Ba2+、OH-、I- |
| C、Mg2+、Fe3+、Br-、HCO3- |
| D、Na+、Mg2+、Cl-、AlO2- |
下列醇可以发生消去反应且所得产物无同分异构体的是( )
A、 |
B、 |
| C、CH3OH |
D、 |