题目内容
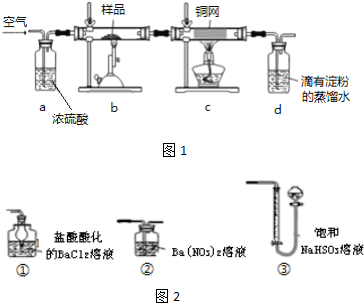
5.除去括号中的杂质不正确的是( )| A. | 乙烯(SO2、H2O):碱石灰,洗气 | B. | 乙烷(乙烯):酸性 KMnO4,洗气 | ||
| C. | 炭粉(MnO2):热的浓盐酸,过滤 | D. | Cl2(HCl):饱和食盐水,洗气 |
分析 A.二氧化硫、水可被碱石灰吸收;
B.乙烯被氧化生成二氧化碳气体;
C.加热条件下,二氧化锰与浓盐酸发生氧化还原反应;
D.氯气难溶于饱和食盐水.
解答 解:A.二氧化硫、水可被碱石灰吸收,而乙烯不反应,可用于除杂,故A正确;
B.乙烯被氧化生成二氧化碳气体,引入新杂质,应用溴水除杂,故B错误;
C.加热条件下,二氧化锰与浓盐酸发生氧化还原反应,可用于除杂,故C正确;
D.氯气难溶于饱和食盐水,可用饱和食盐水除去氯化氢,故D正确.
故选B.
点评 本题考查物质分离提纯及除杂,为高频考点,把握物质的性质及混合物分离、提纯方法为解答的关键,注意除杂的原则,题目难度不大.

练习册系列答案
相关题目
15.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,22.4 L乙烯中C-H键数为4NA | |
| B. | 1 mol羟基中电子数为10NA | |
| C. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| D. | 常温下,1 L 0.1 mol•L-1 的NH4NO3溶液中氮原子数为0.2NA |
16.学习一门科学知识,是想利用科学知识解释生活当中的现象以及创造更加美好的生活,某同学学习了蛋白质变性的性质之后,就试着设计方法来对食物进行消毒,其中合理的是( )
| A. | 煮沸水消灭水当中的细菌 | |
| B. | 加强酸或强碱对餐具进行消毒 | |
| C. | 用甲醛气体对食物进行消毒 | |
| D. | 用重金属盐消毒后加牛奶冲洗后再食用 |
13.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 | |
| B. | 苯不能使酸性高锰酸钾褪色,说明苯环中没有碳碳双键 | |
| C. | 甲烷中混有的乙烯可以用溴的四氯化碳溶液除去 | |
| D. | 医院用75%酒精杀菌、消毒,75%是指质量分数 |
17.下列反应的离子方程式书写不正确的是( )
| A. | 淀粉碘化钾溶液加酸后变蓝:4I-+O2+4H+═2I2+2H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | 在Fe(NO3)2和KI组成的混合溶液中滴入少量稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 向NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应是:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Fe(OH)3↓ |
14.下列叙述正确的是( )
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物  的消去(分子内脱水)产物只有2种 的消去(分子内脱水)产物只有2种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2═CH-COOCH3 | |
| D. | 可用溴水鉴别已烯、四氯化碳和乙酸 |
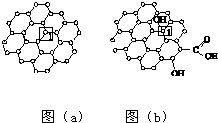 石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].