题目内容
12.实验室用纯碱(Na2CO3•10H2O)配制480mL 0.1mol/L Na2CO3溶液,实际操作步骤有:(1)需称量纯碱的质量为14.3g
(2)配制溶液时下列仪器中:
A.锥形瓶 B.托盘天平 C.烧杯 D.胶头滴管 E.药匙
不需要用到的是A(填序号),尚缺的玻璃仪器有500mL容量瓶和玻璃棒(写名称).
(3)人们常将配制过程简述为以下各步骤:
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移 H.装瓶.
其正确的操作顺序应是① (填序号).
①B E A G C G D F H ②B E G A C G F D H
③B E F G C G D H A ④B E A G C G D H F
(4)在此配制过程中,下列情况会使配制结果偏高的是①④ (填序号)
①纯碱晶体部分失水 ②容量瓶使用时未干燥
③移液时未洗涤烧杯和玻璃棒 ④定容时俯视刻度线观察液面
⑤定容时仰视刻度线观察液面
⑥摇匀后静置,发现液面低于刻度线,再加蒸馏水补至刻度线.
分析 (1)依据m=CVM计算需要溶质的质量;
(2)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(3)依据配制一定物质的量浓度溶液的一般步骤排序;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)要用纯碱(Na2CO3•10H2O)配制480mL 0.1mol/L Na2CO3溶液,应选择500mL容量瓶,实际配制500mL溶液,则需要溶质Na2CO3•10H2O的质量m=0.1mol/L×0.5L×286g/mol=14.3g;
故答案为;14.3;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、移液、洗涤、定容等,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以用不到锥形瓶,还缺少的仪器:500mL容量瓶 玻璃棒;
故答案为:A 500mL容量瓶 玻璃棒;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,所以正确的顺序为:①;
(4)①纯碱晶体部分失水,导致溶质的物质的量偏大,溶液浓度偏高,故选;
②容量瓶使用时未干燥,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
③移液时未洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低,故不选;
④定容时俯视刻度线观察液面,导致溶液体积偏小,溶液浓度偏高,故选;
⑤定容时仰视刻度线观察液面,导致溶液体积偏大,溶液浓度偏低,故不选;
⑥摇匀后静置,发现液面低于刻度线,再加蒸馏水补至刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;
故选:①④.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作步骤是解题关键,注意误差分析的方法和技巧,题目难度不大.

| X | Y | |
| Z | W |
| A. | 四种短周期元素中W的原子半径最小 | |
| B. | Z元素在周期表中的位置是第三周期第ⅣA族 | |
| C. | 原子最外层电子数由多到少的顺序:Y>X>W>Z,最高正价由高到低顺序:W>Z | |
| D. | 元素非金属性由强到弱的顺序:W>Z,W的单质常温下可与氢氧化钠溶液反应 |
| A. | 任何化学反应都伴随有能量的变化 | |
| B. | 化学能与电能的相互转化必须通过一定的装置 | |
| C. | 太阳能、风能、氢能、电能都是可再生的新能源 | |
| D. | 能源的开发和利用情况可以衡量一个国家或地区的经济发展和科学技术水平 |
| A. | 1mol甲醇中含有C-H键的数目为4NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 0.1mol的CaC2中含阴离子数是0.1NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO${\;}_{3}^{-}$和CO${\;}_{3}^{2-}$离子数之和为0.1NA |
| A. | pH增大 | B. | c(CH3COOH)增大 | ||
| C. | CH3COOH电离程度增大 | D. | c(H+)×c(OH-)=1×10-14 |
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
| A. | 硫酸和氢氧化钡 | B. | 氢氧化铜和盐酸 | C. | 盐酸和氨水 | D. | 氢氧化钠和硫酸 |
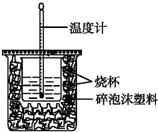 (1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: