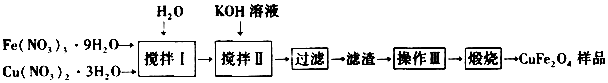
题目内容
16.下列实验操作能达到实验目的是( )| 实验目的 | 实验操作 | |
| A | 配制1.0mol/L CuSO4溶液 | 把25g胆矾晶体溶于水配成100mL溶液 |
| B | 证明某溶液中含有SO42- | 向该溶液中滴入BaCl2溶液 |
| C | 实验室制大量CO2 | 向稀硫酸中加入大理石 |
| D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.25g胆矾晶体的物质的量为$\frac{25g}{250g/mol}$=0.1mol,c=$\frac{0.1mol}{0.1L}$=1mol/L;
B.应先加盐酸排除干扰;
C.生成硫酸钙微溶,阻止反应的发生;
D.饱和的FeCl3溶液滴加到热NaOH溶液中,生成沉淀.
解答 解:A.25g胆矾晶体的物质的量为$\frac{25g}{250g/mol}$=0.1mol,c=$\frac{0.1mol}{0.1L}$=1mol/L,则把25g胆矾晶体溶于水配成100mL溶液可配制1.0mol/L CuSO4溶液,故A正确;
B.应先加盐酸排除干扰,再加氯化钡检验硫酸根离子,故B错误;
C.生成硫酸钙微溶,阻止反应的发生,应选碳酸钙与盐酸制备二氧化碳,故C错误;
D.饱和的FeCl3溶液滴加到热NaOH溶液中,生成沉淀,应饱和的FeCl3溶液滴加到沸水中制备胶体,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握溶液配制、离子检验、胶体制备、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
4.下列各组离子能大量共存的是( )
| A. | Na+、Mg2+、CO32-、I- | B. | H+、NO3-、Fe2+、Br- | ||
| C. | NH4+、K+、SO42-、Cl- | D. | Na+、S2-、Cu2+、SO32- |
11.向盛有饱和碳酸钠溶液的烧杯中,插入惰性电极,接通直流电源,保持温度不变,一定时间后,溶液中( )
| A. | Na2CO3浓度减小 | B. | Na2CO3浓度增大 | ||
| C. | Na2CO3浓度增大,并有晶体析出 | D. | Na2CO3浓度不变,并有晶体析出 |
1.已知等浓度的HF和NaF的混合溶液呈酸性,溶液中存在以下平衡:①HF?F-+H+;②F-+H2O?HF+OH-.常温下,向c(HF)+c(NaF)=0.1mol•L-1的溶液中分别加入以下物质,下列有关说法不正确的是( )
| A. | 加入少量Na2CO3固体,平衡①右移,平衡②左移,溶液中c(F-)增大 | |
| B. | 加入少量NaOH固体至c(F-)>c(HF),溶液一定呈碱性 | |
| C. | 加入少量Na至pH=8,则C(Na+)-c(F-)=0.99×10-7mol•L-1 | |
| D. | 加入少量盐酸,$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$不变 |
5.锂电池反应原理如下:FePO4+Li$?_{充电}^{放电}$LiFePO4,内部为能够导电的固体电解质.下列有关该电池说法正确的是( )
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 放电时,Li发生还原反应 | |
| D. | 放电时电池正极反应为:FePO4+e-+Li+═LiFePO4 |
18.现用0.1mol/LHCl滴定10ml 0.05mol/L氢氧化钠溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是( )
| A. | 10ml | B. | 5ml | C. | 大于5ml | D. | 小于5ml |
 在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下: