题目内容
1.已知等浓度的HF和NaF的混合溶液呈酸性,溶液中存在以下平衡:①HF?F-+H+;②F-+H2O?HF+OH-.常温下,向c(HF)+c(NaF)=0.1mol•L-1的溶液中分别加入以下物质,下列有关说法不正确的是( )| A. | 加入少量Na2CO3固体,平衡①右移,平衡②左移,溶液中c(F-)增大 | |
| B. | 加入少量NaOH固体至c(F-)>c(HF),溶液一定呈碱性 | |
| C. | 加入少量Na至pH=8,则C(Na+)-c(F-)=0.99×10-7mol•L-1 | |
| D. | 加入少量盐酸,$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$不变 |
分析 A.加入少量Na2CO3固体,会消耗H+;
B.等浓度的HF和NaF溶液中,HF的电离程度大于F-的水解程度,溶液显酸性;
C.根据电荷守恒分析;
D.$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$为常数,只与温度有关.
解答 解:A.加入少量Na2CO3固体,会消耗H+,则HF?F-+H+的电离平衡右移,F-的浓度增大,所以F-+H2O?HF+OH-左移,故A正确;
B.等浓度的HF和NaF溶液中,HF的电离程度大于F-的水解程度,溶液显酸性,c(F-)>c(HF),所以溶液不一定呈碱性,故B错误;
C.加入少量Na至pH=8,溶液转化电荷守恒为c(F-)+c(OH-)=c(H+)+c(Na+),则c(Na+)-c(F-)=c(OH-)-c(H+)=0.99×10-7mol•L-1,故C正确;
D.$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$为常数,只与温度有关,所以加入少量盐酸$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$不变,故D正确.
故选B.
点评 本题考查电解质溶液,涉及弱电解质的电离和盐类的水解、三大守恒关系的应用,把握平衡分析和溶液中离子浓度关系判断是解题关键,题目难度中等.

练习册系列答案
相关题目
11.用中和滴定法测定烧碱的纯度,准确称取烧碱样品5.0g,将样品配成250mL的待测液,若烧碱中含有不与酸反应的杂质,试根据实验回答:
(1)取10.00mL待测液,用碱式滴定管量取注入锥形瓶中.(填仪器名称)
(2)用0.2000mol•L-1标准盐酸溶液滴定待测烧碱溶液,用酚酞试液作指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶颜色变化,直到滴定终点.达到滴定终点的标志是溶液颜色由红色变为无色,且半分钟保持不变
(3)下列实验操作中,会引起测定结果偏低的(填字母)AC
A.滴定前酸式滴定管下端无气泡,滴定后酸式滴定管下端出现气泡;
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸;
C.滴定时,反应容器摇动太激烈,有少量液体溅出;
D.滴定到终点时,滴定管尖嘴悬有液滴.
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度:0.4000mol•L-1.
(5)根据上述测定数据,分析得到合理数据,计算烧碱的纯度为80%(用百分数表示,保留三位有效数字).
(1)取10.00mL待测液,用碱式滴定管量取注入锥形瓶中.(填仪器名称)
(2)用0.2000mol•L-1标准盐酸溶液滴定待测烧碱溶液,用酚酞试液作指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶颜色变化,直到滴定终点.达到滴定终点的标志是溶液颜色由红色变为无色,且半分钟保持不变
(3)下列实验操作中,会引起测定结果偏低的(填字母)AC
A.滴定前酸式滴定管下端无气泡,滴定后酸式滴定管下端出现气泡;
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸;
C.滴定时,反应容器摇动太激烈,有少量液体溅出;
D.滴定到终点时,滴定管尖嘴悬有液滴.
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度:0.4000mol•L-1.
| 滴定次数 | 待测液体积/mL | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 26.70 |
12.下列说法正确的是( )
| A. | 任何条件下,反应2CO2(g)═2CO(g)+O2(g)均不能自发进行 | |
| B. | 依据反应I2+2S2O32-═2I-+S4O62-,若要测定平衡体系I2+I-?I3-中平衡时的 c(I2),可用已知物质的量浓度的Na2S2O3溶液进行滴定实验 | |
| C. | 向含有苯酚的苯溶液中滴入少量浓溴水未见白色沉淀,是因为生成的三溴苯酚又溶于苯中 | |
| D. | 检验某物质是否含有Fe2O3的操作步骤是:样品粉碎→加水溶解→过滤,向滤液中滴加KSCN溶液 |
16.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 配制1.0mol/L CuSO4溶液 | 把25g胆矾晶体溶于水配成100mL溶液 |
| B | 证明某溶液中含有SO42- | 向该溶液中滴入BaCl2溶液 |
| C | 实验室制大量CO2 | 向稀硫酸中加入大理石 |
| D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
| A. | A | B. | B | C. | C | D. | D |
6.如表是不同温度下水的离子积常数:
试回答以下问题:
(1)90℃时,将pH=3的硫酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=2.05×10-11mol/L(保留三位有效数字).
(2)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=90:11;
(3)假设H2SO4是强酸,但常温下0.1mol•L-1H2SO4的溶液中c(H+)=0.11mol•L-1,则Na2SO4溶液呈碱性(填“酸”、“碱”或“中”),0.1mol•L-1的NaHSO4溶液的c(H+)>0.01mol•L-1(填“>”、“<”或“=”) H2SO4溶液与Na2SO4溶液反应的离子方程式为H++SO42-=HSO4-.
(4)25℃时pH=5的H2SO4溶液加水稀释到10倍,则稀释后c(SO42-)与c(H+)的比值为1:2;再加水稀释到100倍,则稀释后c(SO42-)与c(H+)的比值为1:20.
| 温度/℃ | 25 | 90℃ | 100℃ |
| 水的离子积常数 | 1×10-14 | 3.8×10-13 | 1×10-12 |
(1)90℃时,将pH=3的硫酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=2.05×10-11mol/L(保留三位有效数字).
(2)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=90:11;
(3)假设H2SO4是强酸,但常温下0.1mol•L-1H2SO4的溶液中c(H+)=0.11mol•L-1,则Na2SO4溶液呈碱性(填“酸”、“碱”或“中”),0.1mol•L-1的NaHSO4溶液的c(H+)>0.01mol•L-1(填“>”、“<”或“=”) H2SO4溶液与Na2SO4溶液反应的离子方程式为H++SO42-=HSO4-.
(4)25℃时pH=5的H2SO4溶液加水稀释到10倍,则稀释后c(SO42-)与c(H+)的比值为1:2;再加水稀释到100倍,则稀释后c(SO42-)与c(H+)的比值为1:20.
13.下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
| 选项 | 微粒组 | 所加试剂 | 离子方程式 |
| A | NH4+、Mg2+、SO42- | 少量Ba(OH)2溶液 | NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O |
| B | Mg2+、HCO3-、Cl- | 过量NaOH溶液 | Mg2++2HCO3-+2OH-=MgCO3-↓+CO32-+2H2O |
| C | H+、Na+、NO3- | Fe粉 | Fe+2H+=Fe2++H2↑ |
| D | Ca2+、NH3•H2O、Cl- | 通入过量CO2 | NH3•H2O+CO2=NH4++HCO3- |
| A. | A | B. | B | C. | C | D. | D |
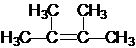 名称为2,3-二甲基-2-丁烯
名称为2,3-二甲基-2-丁烯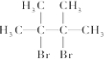
 .
.