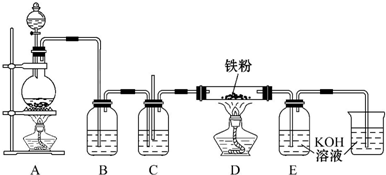
题目内容
7. 在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+$\frac{\underline{\;75℃-85℃\;}}{\;}$2Mn2++10CO2+8H2O
(1)若用托盘天平称取W g Na2C2O4晶体,称量开始时和称量结束时的共同操作步骤是把游码拨回零处.若需移动游码,应用镊子拨动游码.
(2)若将W g Na2C2O4配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中.判断滴定达到终点的现象是滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色.
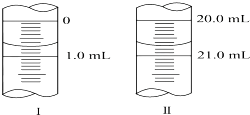
(3)若滴定管的起始读数和终点读数如图所示,则酸性KMnO4的物质的量浓度为$\frac{2w}{67}$mol•L-1(填表达式).
(4)若滴定完毕立即读数,测定的KMnO4溶液的浓度偏低(填“偏高”、“偏低”或“不变”).
分析 (1)称量固体时,无论开始时,还是称量结束时,都需移动游码,;使用天平时,移动游码,应用镊子拨动游码;
(2)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管;KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色为滴定到终点;
(3)根据滴定管的结构、精确度以及测量原理来解答;根据关系式KMnO4~5Na2C2O4来计算;
(4)根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)若用托盘天平称取W g Na2C2O4晶体,称量开始时和称量结束时的共同操作步骤是移动游码,使游码回零处,;称量时需移动游码,应用镊子拨动游码,
故答案为:把游码拨回零处;镊子;
(2)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应装在酸式滴定管中;KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色为滴定到终点,
故答案为:酸式;滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色;
(3)滴定管的起始读数为0.70mL,终点读数为20.70mL,酸性KMnO4溶液消耗的体积为20.70mL-0.70mL=20.00mL;
KMnO4溶液的物质的量浓度为c,WgNa2C2O4配成100mL标准溶液,20.00mL溶液中含有Na2C2O4的质量为$\frac{w}{5}$g;
2KMnO4 ~5Na2C2O4
2moL 5×134g
0.02L×c $\frac{w}{5}$g
解得:c=$\frac{2w}{67}$mol•L-1,
故答案为:$\frac{2w}{67}$mol•L-1;
(4)溶液变色因局部过量而实际未达终点,立即读数会造成V(标准)减小,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$可知,所测结果偏低,
故答案为:偏低.
点评 本题主要考查了氧化还原反应滴定,涉及指示剂的原理、化学计算以及误差分析,考查了学生分析问题和解决问题的能力.

| A. | 12g石墨和C60的混合固体中,含NA个碳原子 | |
| B. | 标准状况下,2.24L水中含有0.1NA个水分子 | |
| C. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| D. | 5.6g铁在足量氯气中燃烧,电子转移数目为0.2NA |
| A. | 放出碱液的滴定管开始有气泡,发出液体后气泡消失 | |
| B. | 滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定 | |
| C. | 锥形瓶用蒸馏水洗涤后,直接加入待测溶液滴定 | |
| D. | 滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定 |
| A. | 任何条件下,反应2CO2(g)═2CO(g)+O2(g)均不能自发进行 | |
| B. | 依据反应I2+2S2O32-═2I-+S4O62-,若要测定平衡体系I2+I-?I3-中平衡时的 c(I2),可用已知物质的量浓度的Na2S2O3溶液进行滴定实验 | |
| C. | 向含有苯酚的苯溶液中滴入少量浓溴水未见白色沉淀,是因为生成的三溴苯酚又溶于苯中 | |
| D. | 检验某物质是否含有Fe2O3的操作步骤是:样品粉碎→加水溶解→过滤,向滤液中滴加KSCN溶液 |
| 实验目的 | 实验操作 | |
| A | 配制1.0mol/L CuSO4溶液 | 把25g胆矾晶体溶于水配成100mL溶液 |
| B | 证明某溶液中含有SO42- | 向该溶液中滴入BaCl2溶液 |
| C | 实验室制大量CO2 | 向稀硫酸中加入大理石 |
| D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
| A. | A | B. | B | C. | C | D. | D |