题目内容
4.下列各组离子能大量共存的是( )| A. | Na+、Mg2+、CO32-、I- | B. | H+、NO3-、Fe2+、Br- | ||
| C. | NH4+、K+、SO42-、Cl- | D. | Na+、S2-、Cu2+、SO32- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.Mg2+、CO32-结合生成沉淀,不能共存,故A不选;
B.H+、NO3-、Fe2+发生氧化还原反应,不能共存,故B不选;
C.该组离子之间不反应,可大量共存,故C选;
D.S2-、Cu2+结合生成沉淀,Cu2+、SO32-相互促进水解生成沉淀,不能共存,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、复分解反应判断,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案
相关题目
20.25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进(填“促进”、“抑制”或“不影响”).
已知如表数据.
已知如表数据.
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
12.下列说法正确的是( )
| A. | 任何条件下,反应2CO2(g)═2CO(g)+O2(g)均不能自发进行 | |
| B. | 依据反应I2+2S2O32-═2I-+S4O62-,若要测定平衡体系I2+I-?I3-中平衡时的 c(I2),可用已知物质的量浓度的Na2S2O3溶液进行滴定实验 | |
| C. | 向含有苯酚的苯溶液中滴入少量浓溴水未见白色沉淀,是因为生成的三溴苯酚又溶于苯中 | |
| D. | 检验某物质是否含有Fe2O3的操作步骤是:样品粉碎→加水溶解→过滤,向滤液中滴加KSCN溶液 |
16.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 配制1.0mol/L CuSO4溶液 | 把25g胆矾晶体溶于水配成100mL溶液 |
| B | 证明某溶液中含有SO42- | 向该溶液中滴入BaCl2溶液 |
| C | 实验室制大量CO2 | 向稀硫酸中加入大理石 |
| D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
| A. | A | B. | B | C. | C | D. | D |
13.下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
| 选项 | 微粒组 | 所加试剂 | 离子方程式 |
| A | NH4+、Mg2+、SO42- | 少量Ba(OH)2溶液 | NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O |
| B | Mg2+、HCO3-、Cl- | 过量NaOH溶液 | Mg2++2HCO3-+2OH-=MgCO3-↓+CO32-+2H2O |
| C | H+、Na+、NO3- | Fe粉 | Fe+2H+=Fe2++H2↑ |
| D | Ca2+、NH3•H2O、Cl- | 通入过量CO2 | NH3•H2O+CO2=NH4++HCO3- |
| A. | A | B. | B | C. | C | D. | D |
6.已知:25℃时,Ksp( FeS)=6.3xl0-18;ksp( CuS)=1.3xl0-36;Ksp( ZnS)=1.6xl0-24.下列叙述正确的是( )
| A. | 25℃时,FeS,ZnS、CuS的溶解度依次增大 | |
| B. | ZnS饱和溶液中加入少量NazS固体,平衡后溶液中c(Zn2+)•c(S2-)=Ksp(ZnS),c(Zn2+)=c(S2-) | |
| C. | 除去工业废水中的Cu2+,可用FeS作为沉淀剂 | |
| D. | 某溶液中含有Fe2+、Cu2+和Znz+,浓度均为0.010 moI•L-1.向该溶液中逐滴加入0.010 mol•L-1的Na2S溶液时,Fe2+最先沉淀出来 |
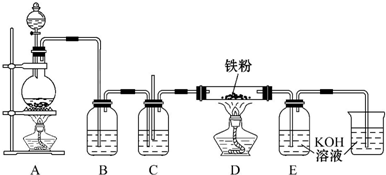
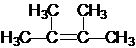 名称为2,3-二甲基-2-丁烯
名称为2,3-二甲基-2-丁烯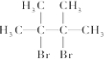
 .
.