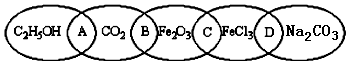
题目内容
6.(1)实验室有如下物质:①盐酸 ②熔融NaCl③石墨 ④CO2⑤AgCl⑥CH3COOH ⑦NaOH溶液⑧Al2O3 ⑨酒精.其中能导电的有①②③⑦(填序号,下同),属于电解质的有②⑤⑥⑧,属于非电解质的有④⑨,属于强电解质的②⑤⑧,属于弱电解质的有⑥.
(2)请写出NaCI和CH3COOH的电离方程式:
NaCl:NaCl=Na++Cl-;
CH3COOH:CH3COOH?CH3COO-+H+.
分析 (1)含自由移动的离子或电子的物质能导电;在水溶液中或熔融状态下能导电的化合物为电解质;在水溶液中和熔融状态下均不能导电的化合物为非电解质;在水溶液中能完全电离的为强电解质,只能部分电离的为弱电解质;
(2)NaCl是强电解质,能完全电离为钠离子和氯离子;
CH3COOH是弱电解质,只能部分电离为氢离子和醋酸根,据此分析.
解答 解:(1)①盐酸是混合物,既不是电解质也不是非电解质,含自由移动的离子,故能导电;
②熔融NaCl含自由移动的离子,故能导电,是电解质,且是强电解质;
③石墨是单质,能导电,但既不是电解质也不是非电解质;
④CO2是非电解质,不能导电;
⑤AgCl不能导电,是电解质中的强电解质;
⑥CH3COOH不能导电,是电解质中的弱电解质;
⑦NaOH溶液是混合物,能导电,但既不是电解质也不是非电解质;
⑧Al2O3 不能导电,是电解质中的强电解质;
⑨酒精是非电解质;
故答案为:①②③⑦;②⑤⑥⑧;④⑨;②⑤⑧;⑥;
(2)NaCl是强电解质,能完全电离为钠离子和氯离子,电离方程式为:NaCl=Na++Cl-,故答案为:NaCl=Na++Cl-;
CH3COOH是弱电解质,只能部分电离为氢离子和醋酸根,故用可逆号,故电离方程式为:CH3COOH?CH3COO-+H+.故答案为:CH3COOH?CH3COO-+H+;
点评 本题考查了电解质、非电解质、强弱电解质的区别以及电离方程式的书写,应注意强电解质和弱电解质的本质区别是电离程度,和溶解度无关.

练习册系列答案
相关题目
2.在相同条件下,下面各组热化学方程式中,△H1>△H 2的是( )
| A. | 2H2(g)+O2(g)=2H2O(l);△H1 2H2(g)+O2(g)=2H2O(g);△H2 | |
| B. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g)△H2 | |
| C. | H2(g)+Cl2(g)=2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H2 | |
| D. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 |
17.下列表示式错误的是( )
| A. | Na+的电子排布图: | B. | Na+的结构示意图: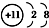 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化电子排布式:[Ne]3s1 |
14.下列物质能用于制造光导纤维的是( )
| A. | 钢 | B. | 陶瓷 | C. | 玻璃 | D. | 二氧化硅 |
11.向盛有饱和碳酸钠溶液的烧杯中,插入惰性电极,接通直流电源,保持温度不变,一定时间后,溶液中( )
| A. | Na2CO3浓度减小 | B. | Na2CO3浓度增大 | ||
| C. | Na2CO3浓度增大,并有晶体析出 | D. | Na2CO3浓度不变,并有晶体析出 |
8. NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).
(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为H2PO4-?HPO42-+H+.
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为HPO42-+H2O?H2PO4-+OH-.
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
样品1.3000g$\stackrel{稀硝酸}{→}$H3PO4$→_{调pH到3-4}^{用NaOH(aq)}$NaH2PO4→$\stackrel{配成100.00mL}{溶液A}$$\stackrel{取样}{→}$$→_{指示剂X}^{0.1000mol.L-1NaOH溶液滴}$Na2HPO4
1滴定时所用的指示剂X可为酚酞.
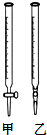
②NaOH标准溶液应盛放在如图所示的滴定管乙(选填:“甲”或“乙”) 中.
③滴定实验记录如下表(样品中杂质不与酸或碱反应).
计算样品中Na5P3O10的质量分数75.5%(不要求列出计算过程,结果保留三位有效数字).
 NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为H2PO4-?HPO42-+H+.
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为HPO42-+H2O?H2PO4-+OH-.
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
样品1.3000g$\stackrel{稀硝酸}{→}$H3PO4$→_{调pH到3-4}^{用NaOH(aq)}$NaH2PO4→$\stackrel{配成100.00mL}{溶液A}$$\stackrel{取样}{→}$$→_{指示剂X}^{0.1000mol.L-1NaOH溶液滴}$Na2HPO4
1滴定时所用的指示剂X可为酚酞.
②NaOH标准溶液应盛放在如图所示的滴定管乙(选填:“甲”或“乙”) 中.
③滴定实验记录如下表(样品中杂质不与酸或碱反应).
| 滴定次数 | 待测溶液A的体积(/mL) | 0.1000mol•L-1NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |