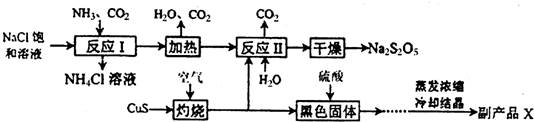
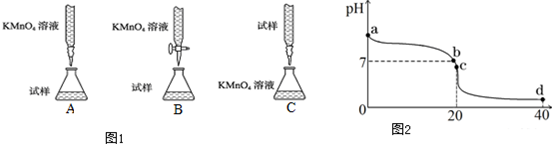
题目内容
17.下列表示式错误的是( )| A. | Na+的电子排布图: | B. | Na+的结构示意图: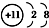 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化电子排布式:[Ne]3s1 |
分析 A.同一轨道内的2个电子自旋方向应该相反;
B.Na+核外电子数为10,有2个电子层,各层电子数为2、8;
C.Na原子核外电子数为11;
D.钠原子的内层电子排布为1s22s22p6,应是Ne的排布式.
解答 解:A.同一轨道内的2个电子自旋方向应该相反,钠原子失去3s的1个电子形成钠离子,钠离子核外有10个电子,Na+的电子排布图: ,故A错误;
,故A错误;
B.Na+核外电子数为10,有2个电子层,各层电子数为2、8,结构示意图为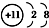 ,故B正确;
,故B正确;
C.Na原子核外电子数为11,则钠原子的核外电子排布式为1s22s22p63s1,故C正确;
D.钠原子的核外电子排布式为1s22s22p63s1,内层电子排布为1s22s22p6,Na原子的简化电子排布式:[Ne]3s1,故D正确;
故选A.
点评 本题考查常用化学用语的书写,难度中等,注意理解掌握核外电子排布规律.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.某学生用NaOH标准溶液滴定未知浓度的盐酸,进行了如下实验:
取15.00mL待测溶液于250mL锥形瓶中,加入1~2滴酚酞试液,用NaOH标准溶液滴定.按上述操作方法再重复2次.
(1)填空:(①、②小题中选填“偏高”、“偏低”或“无影响”)
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则待测液的浓度偏高;
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响;
③滴定时边滴边摇动锥形瓶,眼睛应观察b(选填编号)
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成浅红色.
(2)滴定结果如表所示:
若NaOH标准溶液的浓度为0.1010mol/L,则该待测液的浓度为0.1347mol/L.
取15.00mL待测溶液于250mL锥形瓶中,加入1~2滴酚酞试液,用NaOH标准溶液滴定.按上述操作方法再重复2次.
(1)填空:(①、②小题中选填“偏高”、“偏低”或“无影响”)
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则待测液的浓度偏高;
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响;
③滴定时边滴边摇动锥形瓶,眼睛应观察b(选填编号)
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成浅红色.
(2)滴定结果如表所示:
| 滴定次数 | 标准溶液的体积/mL | 待测盐酸溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 1.05 | 21.10 | 15.00 |
| 2 | 2.00 | 21.95 | 15.00 |
7.下列状态的物质,既能导电又属于电解质的是( )
| A. | 熔融的KOH | B. | KOH溶液 | C. | 浓硫酸 | D. | KOH晶体 |
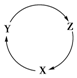 下列各组物质中,满足如图物质一步转化关系的选项是( )
下列各组物质中,满足如图物质一步转化关系的选项是( )