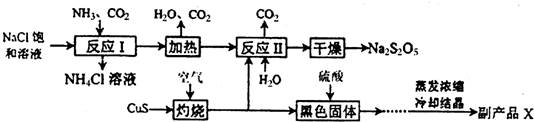
题目内容
2.在相同条件下,下面各组热化学方程式中,△H1>△H 2的是( )| A. | 2H2(g)+O2(g)=2H2O(l);△H1 2H2(g)+O2(g)=2H2O(g);△H2 | |
| B. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g)△H2 | |
| C. | H2(g)+Cl2(g)=2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H2 | |
| D. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 |
分析 A、生成物中,气态水含有的能量大于液态水,则反应放出的热量减小,焓变变大;
B、固体硫单质转化为气体硫单质的过程需要吸收能量;
C、热化学方程式中放入的热量与化学计量数成正比,计量数越大,放出的热量越多,焓变△H值越小;
D、二氧化碳完全燃烧放出的热量高于不完全燃烧放出的热量,放热越多,焓变越小.
解答 解:A、气态水的能量大于液态水,△H1生成的是液态水,生成物含有的能量越高,则放出的热量越小,焓变△H值越大,则两个反应的焓变值大小为:△H1<△H2,故A错误;
B、固体硫单质转化为气体硫单质的过程需要吸收能量,气体硫单质燃烧放热多,但是焓变小,所以△H1<△H2,故B错误;
C、热化学方程式中放入的热量与化学计量数成正比,计量数越大,放出的热量越多,焓变△H值越小,即△H1<△H2,故C错误;
D、二氧化碳完全燃烧放出的热量高于不完全燃烧放出的热量,放热越多,焓变越小,△H1>△H 2,故D正确.
故选D.
点评 本题考查了反应热的大小比较,题目难度中等,注意掌握化学反应与能量变化的关系,明确放热反应中:放热的热量越大,焓变值越小;反应物具有的能量越高,放热的热量越大,焓变值越小;生成物具有的能量越高,放出的能量越小,焓变值越大.

练习册系列答案
相关题目
12.NaOH溶液导电的原因是含有( )
| A. | 自由移动的分子 | B. | 自由移动的离子 | C. | 自由移动的电子 | D. | 自由移动的原子 |
10.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A. | 将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性 | |
| B. | 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 | |
| C. | 向纯水中加入少量氢氧化钠固体,c(H+)减小,Kw不变 | |
| D. | 向纯水中加入盐酸,将抑制水的电离,Kw变小 |
17.下列说法错误的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| D. | 古剑“湛泸”“以剂钢为刃,剂钢指的是铁的合金 |
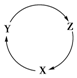 下列各组物质中,满足如图物质一步转化关系的选项是( )
下列各组物质中,满足如图物质一步转化关系的选项是( )