题目内容
(1)反应aA(g)═bB(g)+cC(g)在一容积不变的容器内进行,反应达到平衡(以下填“增大”、“减小”或“不变”).
①若a=b+c,增大A的浓度,A的转化率 .
②若a>b+c,增大A的浓度,A的转化率 .
(2)若反应aA(g)+bB(g)═cC(g)+dD(g),容器体积固定不变,且起始时A与B的物质的量之比为a:b.
①平衡时A与B的转化率之比是 .
②若增大A的浓度,则A的转化率 .
③若同时同等倍数地增大A、B的浓度,则a+b与c+d满足什么关系时,A与B的转化率同时增大?a+b c+d(填“>”“=”或“<”).
①若a=b+c,增大A的浓度,A的转化率
②若a>b+c,增大A的浓度,A的转化率
(2)若反应aA(g)+bB(g)═cC(g)+dD(g),容器体积固定不变,且起始时A与B的物质的量之比为a:b.
①平衡时A与B的转化率之比是
②若增大A的浓度,则A的转化率
③若同时同等倍数地增大A、B的浓度,则a+b与c+d满足什么关系时,A与B的转化率同时增大?a+b
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)增大A的浓度,等效为增大压强,增大压强平衡向气体体积减小的方向移动,据此判断A的转化率;
(2)①起始时A与B的物质的量之比为a:b,等于化学计量数之比,平衡时A与B的转化率相等;
②若增大A的浓度,平衡向正反应移动,B的转化率增大,A的转化率减小;
③同时同等倍数地增大A、B的浓度,等效为增大压强,A与B的转化率同时增大,平衡向正反应移动.
(2)①起始时A与B的物质的量之比为a:b,等于化学计量数之比,平衡时A与B的转化率相等;
②若增大A的浓度,平衡向正反应移动,B的转化率增大,A的转化率减小;
③同时同等倍数地增大A、B的浓度,等效为增大压强,A与B的转化率同时增大,平衡向正反应移动.
解答:
解:(1)①增大A的浓度,等效为增大压强,若a=b+c,平衡不移动,A的转化率不变,故答案为:不变;
②增大A的浓度,等效为增大压强,若a>b+c,增大压强平衡向气体体积减小的方向移动,即先正反应移动,A的转化率增大,故答案为:增大;
(2)①起始时A与B的物质的量之比为a:b,等于化学计量数之比,平衡时A与B的转化率相等,即平衡时A与B的转化率之比是1:1,故答案为:1:1;
②若增大A的浓度,平衡向正反应移动,B的转化率增大,A的转化率减小,故答案为:减小;
③同时同等倍数地增大A、B的浓度,等效为增大压强,A与B的转化率同时增大,平衡向正反应移动,增大压强平衡向气体体积减小的方向移动,故a+b>c+d,
故答案为:>.
②增大A的浓度,等效为增大压强,若a>b+c,增大压强平衡向气体体积减小的方向移动,即先正反应移动,A的转化率增大,故答案为:增大;
(2)①起始时A与B的物质的量之比为a:b,等于化学计量数之比,平衡时A与B的转化率相等,即平衡时A与B的转化率之比是1:1,故答案为:1:1;
②若增大A的浓度,平衡向正反应移动,B的转化率增大,A的转化率减小,故答案为:减小;
③同时同等倍数地增大A、B的浓度,等效为增大压强,A与B的转化率同时增大,平衡向正反应移动,增大压强平衡向气体体积减小的方向移动,故a+b>c+d,
故答案为:>.
点评:本题考查平衡移动、外界条件对平衡的影响、等效平衡等,难度不大,注意基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
向恒温、恒容(2L)的密闭容器中充入2mol SO2和一定量的O2,发生反应:2SO2(g)+O2(g)
2SO3(g)△H=-197.74kJ?mol-1,4min后达到平衡,这时c(SO2)=0.2mol?L-1,且SO2和O2的转化率相等.下列说法中,不正确的是( )
| 一定条件 |
| A、2 min时,c(SO2)=0.6 mol?L-1 |
| B、用O2表示4 min内的反应速率为0.1 mol?(L?min)-1 |
| C、再向容器中充入1 mol SO3,达到新平衡,n(SO2):n(O2)=2:1 |
| D、4 min后,若升高温度,平衡向逆方向移动,平衡常数K减小 |
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液.观察到的现象是先出现黄色沉淀.最终出现黑色沉淀.已知有关物质的溶度积Ksp(25℃)如下:下列叙述错误的是( )
| AgCl | AgI | Ag2S | |
| Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
| A、沉淀转化的实质就是沉淀溶解平衡的移动 |
| B、溶解度小的沉淀可以转化为溶解度更小的沉淀 |
| C、AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同 |
| D、25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同 |
在一定温度下,可逆反应达到平衡时,生成物平衡浓度的系数次方的乘积与反应物平衡浓度的系数次方的乘积之比是一个常数,该常数就叫做化学平衡常数,用符号K表示.在一定温度下的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g),已知c(SO2)始=0.4mol?L-1,c(O2)始=1mol?L-1经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为( )
| 催化剂 |
| △ |
| A、0.24 mol?L-1 |
| B、0.28 mol?L-1 |
| C、0.32 mol?L-1 |
| D、0.26 mol?L-1 |
关于如图进行的实验的说法,正确的是( )
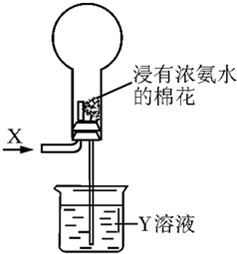

| A、若X为HCl,则烧瓶内可产生白雾 |
| B、选择适当的X和Y溶液可产生有色喷泉 |
| C、若烧瓶内产生喷泉,则Y溶液一定呈酸性 |
| D、若通入气体为Cl2,则烧瓶内一定无喷泉产生 |
两种金属混合物共15g,投入足量的盐酸中,充分反应得1g H2,则原混合物组成中肯定不能为下列的( )
| A、Mg、Ag |
| B、Fe、Mg |
| C、Al、Cu |
| D、Mg、Al |
 多晶硅是太阳能光伏产业的重要原料.
多晶硅是太阳能光伏产业的重要原料.