题目内容
某溶液中可能含有下列5中离子中的某几种:Na+、NH4+、Mg2+、Al3+、Cl-.为确认该溶液组成进行如下实验:①取20.0ml该溶液,加入25.0ml4.00mol/LNaOH溶液,有白色沉淀、无刺激气味气体生成.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至100ml,测得滤液中c(OH-)为0.20mol/L②另取20.0ml该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48g由此可得出关于原溶液组成的正确结论是( )
| A、一定含Mg2+、Al3+、Cl-,不含Na+、NH4+ |
| B、一定含Na+、Mg2+、Cl-,不含NH4+,可能含有Al3+ |
| C、c(Cl-)为4.0mol/L,c(Al3+)为1.0mol/L |
| D、c(Mg2+)为1.0mol/L,c(Na+)为0.5mol/L |
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:①加入NaOH溶液加热,有白色沉淀产生,无刺激气味气体生成,说明原溶液中可能含有Mg2+、Al3+;一定没有NH4+;滤液中c(OH-)=0.2mol?L-1,证明碱过量,一定含有Mg2+;
②加入足量的AgNO3溶液,生成白色沉淀11.48g,溶液中一定含有Cl-;
氢氧化镁1.16g,物质的量是0.02mol,消耗的n(OH-)=0.04mol,加入的氢氧化钠为0.1molmol,滤液中的n(OH-)=0.2mol?L-1×0.1L=0.02mol,故Al3+消耗了0.04mol氢氧化钠生成偏铝酸钠,n(Al3+)=0.01mol;生成白色沉淀11.48g是氯化银,物质的量是0.08mol,氢氧化镁有0.02mol,n(Al3+)=0.01mol,根据电荷守恒,n(Na+)=n(Cl-)-2n(Mg2+)-3n(Al3+),进而确定离子的浓度大小即可.
②加入足量的AgNO3溶液,生成白色沉淀11.48g,溶液中一定含有Cl-;
氢氧化镁1.16g,物质的量是0.02mol,消耗的n(OH-)=0.04mol,加入的氢氧化钠为0.1molmol,滤液中的n(OH-)=0.2mol?L-1×0.1L=0.02mol,故Al3+消耗了0.04mol氢氧化钠生成偏铝酸钠,n(Al3+)=0.01mol;生成白色沉淀11.48g是氯化银,物质的量是0.08mol,氢氧化镁有0.02mol,n(Al3+)=0.01mol,根据电荷守恒,n(Na+)=n(Cl-)-2n(Mg2+)-3n(Al3+),进而确定离子的浓度大小即可.
解答:
解:①25.0mL 4.00mol?L-1NaOH溶液,含有0.1mol氢氧化钠;沉淀1.16g为氢氧化镁,物质的量是0.02mol,生成沉淀消耗0.04mol氢氧化钠;滤液中的n(OH-)=0.2mol?L-1×0.1L=0.02mol,故还有0.04mol氢氧化钠和0.01molAl3+反应生成了偏铝酸钠,故一定含有Mg2+、Al3+;无刺激气味气体生成,一定没有NH4+;
②白色沉淀11.48是氯化银,物质的量是:
=0.08mol,则一定含有氯离子,根据电荷守恒,正电荷有:(0.02mol×2+0.01mol×3)=0.07mol;负电荷有:0.08mol,故一定含有钠离子0.01mol;
A、根据以上分析可知,溶液中一定存在:Na+、Mg2+、Al3+、Cl-,由于一定含有Na+,故A错误;
B、溶液中一定存在:Na+、Mg2+、Al3+、Cl-,即一定含有Al3+,故B错误;
C、c(Al3+)=
=0.5 mol?L-1,c(Cl-)=
=4mol/L,故C错误;
D、c(Mg2+)=
=1.00 mol?L-1,c(Na+)=
=0.50 mol?L-1,故D正确;
故选D.
②白色沉淀11.48是氯化银,物质的量是:
| 11.48 |
| 143.5g/mol |
A、根据以上分析可知,溶液中一定存在:Na+、Mg2+、Al3+、Cl-,由于一定含有Na+,故A错误;
B、溶液中一定存在:Na+、Mg2+、Al3+、Cl-,即一定含有Al3+,故B错误;
C、c(Al3+)=
| 0.01mol |
| 0.02L |
| 0.08mol |
| 0.02L |
D、c(Mg2+)=
| 0.02mol |
| 0.02L |
| 0.01mol |
| 0.02L |
故选D.
点评:本题考查离子反应的简单计算、常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,根据电荷守恒判断钠离子的存在为本题易错点.

练习册系列答案
相关题目
一定量的CH4燃烧后得到的产物是CO、CO2、H2O(g),此混合物的质量为49.6g,当其缓缓通过足量的无水CaCl2时气体质量减少25.2g,则混合气体中CO的质量为( )
| A、24.4g |
| B、13.2g |
| C、12.5g |
| D、11.2g |
两种金属粉末的混合物52g,溶于足量的稀H2SO4中,生成标准状况下的氢气22.4L,则这种混合物不可能是( )
| A、Na和K | B、Mg和Al |
| C、Cu和Al | D、Al和Fe |
已知:
C(s)+O2(g)═CO2(g)△H1
CO2(g)+C(s)═2CO(g)△H2
2CO(g)+O2(g)═2CO2(g)△H3
4Fe(s)+3O2(g)═2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
C(s)+O2(g)═CO2(g)△H1
CO2(g)+C(s)═2CO(g)△H2
2CO(g)+O2(g)═2CO2(g)△H3
4Fe(s)+3O2(g)═2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
| A、△H1>0,△H3<0 |
| B、△H2>0,△H4>0 |
| C、△H1=△H2+△H3 |
| D、△H3=△H4+△H5 |
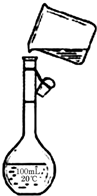 用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空:
用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空: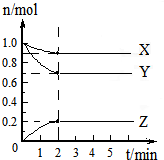 (一)某可逆反应:2A(g)?B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
(一)某可逆反应:2A(g)?B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
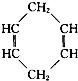 可简写为
可简写为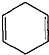 .现有某化合物W的分子结构可表示为
.现有某化合物W的分子结构可表示为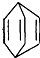 .
.