题目内容
13. 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则CH4(g)将NO2(g)还原为N2(g)的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
①若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式CH3OCH3-12e-+16OH-=2CO32-+11H2O
②在①所确定的电池中,若通入甲醚(沸点为-24.9℃)的速率为1.12L•min-1(标准状况),并以该电池作为电源电解 2mol•L-1 CuSO4溶液500mL,则通电30s后理论上在阴极可析出金属铜9.6g
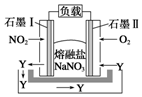
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为NO2+NO3--e-=N2O5.
分析 (1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
结合盖斯定律可知$\frac{①+②}{2}$得到CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);
(2)①若用甲醚作为燃料电池的原料,在碱性介质中电池负极上甲醚失去电子生成碳酸根离子;
②由电子守恒可知,CH3OCH3~12e-~6Cu;
(3)由图可知,通入氧气的一端为正极,石墨I电极反应生成一种氧化物Y,可知NO2失去电子生成N2O5.
解答 解:(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
结合盖斯定律可知$\frac{①+②}{2}$得到CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=$\frac{-574kJ/mol-1160kJ/mol}{2}$=-867 kJ•mol-1,
则CH4(g)将NO2(g)还原为N2(g)的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1;
(2)①若用甲醚作为燃料电池的原料,在碱性介质中电池负极上甲醚失去电子生成碳酸根离子,电极反应为CH3OCH3-12e-+16OH-=2CO32-+11H2O,
故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
②由电子守恒可知,CH3OCH3~12e-~6Cu,则通电30s后理论上在阴极可析出金属Cu为$\frac{1.12L/min×0.5min}{22.4L/mol}$×6×64g/mol=9.6g,
故答案为:9.6;
(3)由图可知,通入氧气的一端为正极,石墨I电极反应生成一种氧化物Y,可知NO2失去电子生成N2O5,则I上电极反应为NO2+NO3--e-=N2O5,
故答案为:NO2+NO3--e-=N2O5.
点评 本题考查热化学方程式及原电池,为高频考点,把握盖斯定律的应用、电极反应的书写为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 氯与钠形成离子键,氯与硅形成共价键 | |
| B. | 向淀粉KI溶液中滴加溴水,溶液变蓝 | |
| C. | 向Na2SO3溶液中滴加盐酸,有气泡生成 | |
| D. | F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应 |
| A. | Ca,Mg,Na | B. | Cl-,S2-,O2- | C. | P3-,S2-,Cl- | D. | K+、Cl-,S2- |
| A. | S2-的结构示意图: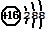 | |
| B. | 过氧化氢的电子式: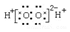 | |
| C. | Ge原子的简化电子排布式:[Ar]4s24p2 | |
| D. | 氯化钠的分子式:NaCl |

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(2)向浸出液中加入NaClO3的离子反应方程式:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)已知:常温下
NH3•H2O?NH4++OH- Kb=1.8×10-5
H2C2O4?H++HC2O4- Ka1=5.4×10-2
HC2O4-?H+C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”).
(4)加入(NH4)2C2O4溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:A.
A.蒸馏水B.自来水C.饱和的(NH4)2C2O4溶液D.稀盐酸
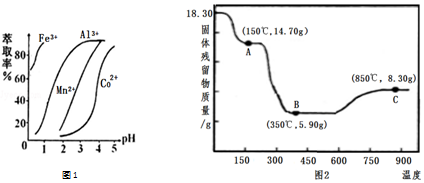
(5)萃取剂对金属离子的萃取率与pH的关系如右图1,萃取剂的作用是除去溶液中的Mn2+;其使用的适宜pH范围是B.
A.2.0~2.5B.3.0~3.5C.4.0~4.5
(6)CoC2O4•2H2O热分解质量变化过程如图2所示.其中600℃以前是隔绝空气加热,600℃以后是在空气中加热.A、B、C均为纯净物;C点所示产物的化学式是Co2O3.
 氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法.
氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法.