题目内容
4.不能用元素周期律解释的是( )| A. | 氯与钠形成离子键,氯与硅形成共价键 | |
| B. | 向淀粉KI溶液中滴加溴水,溶液变蓝 | |
| C. | 向Na2SO3溶液中滴加盐酸,有气泡生成 | |
| D. | F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应 |
分析 A.氯最外层7个电子,容易得到,Na最外层1个电子,容易失去,Si不易失去也不易得到电子;
B.非金属性强的元素单质,能从非金属性弱的非金属盐中置换出该非金属单质;
C.向Na2SO3溶液中加盐酸,发生强酸制取弱酸的反应;
D.非金属性越强,与氢气化合越容易.
解答 解:A.氯最外层7个电子,容易得到,Na最外层1个电子,容易失去,Si不易失去也不易得到,所以钠与硅与氯气形成的化合物不同,可以利用元素周期律解释,故A不选;
B.向淀粉KI溶液中滴入溴水,溶液变蓝,说明溴单质的氧化性强于碘单质,能用元素周期律解释,故B不选;
C.向Na2SO3溶液中加盐酸,发生强酸制取弱酸的反应,HCl不是最高价含氧酸,不能用元素周期律解释,故C选;
D.非金属性F>I,故氟气与氢气化合较容易,可以利用元素周期律解释,故D不选;
故选C.
点评 本题考查原子结构与元素周期律的关系,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意周期律的应用,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
14.某种兴奋剂的结构简式如图所示,下列说法不正确的是( )
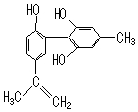

| A. | 该有机物分子式为C16H16O3 | |
| B. | 1 mol该物质与浓溴水反应时,最多消耗3 molBr2 | |
| C. | 该分子中的氢原子不可能都在同一个平面上 | |
| D. | 滴入酸性高锰酸钾溶液,紫色褪去,不能证明结构中存在碳碳双键 |
15.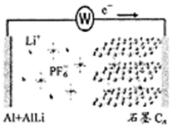 中科院深圳研究院成功开发出一种新型铝-石墨双离子电池,可大幅度提升电动汽车的使用性能,其工作原理如图所示.充电过程中,石墨电极发生阴离于插层反应,而铝电极发生铝-锂合金化反应,下列叙述正确的是( )
中科院深圳研究院成功开发出一种新型铝-石墨双离子电池,可大幅度提升电动汽车的使用性能,其工作原理如图所示.充电过程中,石墨电极发生阴离于插层反应,而铝电极发生铝-锂合金化反应,下列叙述正确的是( )
 中科院深圳研究院成功开发出一种新型铝-石墨双离子电池,可大幅度提升电动汽车的使用性能,其工作原理如图所示.充电过程中,石墨电极发生阴离于插层反应,而铝电极发生铝-锂合金化反应,下列叙述正确的是( )
中科院深圳研究院成功开发出一种新型铝-石墨双离子电池,可大幅度提升电动汽车的使用性能,其工作原理如图所示.充电过程中,石墨电极发生阴离于插层反应,而铝电极发生铝-锂合金化反应,下列叙述正确的是( )| A. | 放电时,电解质中的Li+向左端电极移动 | |
| B. | 充电时,与外加电源负极相连一端电极反应为:AlLi-e-═Li++Al | |
| C. | 充电时,若转移0.2 mol电子,则铝电极上增重5.4 g | |
| D. | 放电时,正极反应式为CR(PF6)+e-═PF6-+CR |
12.下列有关第三周期元素的性质递变的说法错误的是( )
| A. | 从左到右,金属性减弱 | B. | 从左到右,非金属性增强 | ||
| C. | 从左到右,正化合价的数值增大 | D. | 从左到右,原子半径逐渐增大 |
19.可用碱石灰干燥的气体是( )
| A. | H2S | B. | Cl2 | C. | NH3 | D. | SO2 |
16.水的离子积常数随温度升高而升高.关于一定量的水,下列叙述正确的是( )
| A. | 温度升高,水中分子总数减少 | B. | 水中c(OH-)随温度升高而降低 | ||
| C. | 水的pH随温度升高而升高 | D. | 水的电离过程是放热过程 |
14.用下列装置进行实验,不能达到相应实验目的是( )
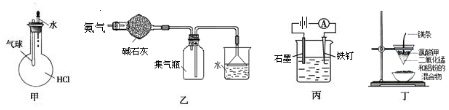

| A. | 如图装置甲:验证HCl气体在水中的溶解度大 | |
| B. | 如图装置乙:可干燥、收集氨气,并吸收多余的氨 | |
| C. | 如图装置丙:防止铁钉生锈 | |
| D. | 如图装置:可制得金属锰 |
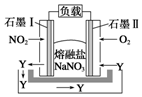 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.