题目内容
5.为检测某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组设计了如下实验流程:
(1)通入N2的目的是使反应产生的SO2气体充分逸出,减小实验误差;
(2)第①步反应的离子方程式是SO2+H2O2→2H++SO42-;
(3)滴定实验若选择酚酞作指示剂,则滴定终点的标志是溶液由无色变为粉红色,且半分钟内不褪色,滴定过程中以下操作使测定结果偏高的是ad(填编号);
a.洗净的滴定管未用标准液润洗b.滴定中向锥形瓶内壁加少量水
c.滴定前滴定管正常,滴定后尖嘴部分有气泡d.锥形瓶用待测液洗涤2-3次
(4)若实验室欲制取SO2可选用试剂ac(填编号);
a.铜和浓硫酸b.硫和氧气c.亚硫酸钠和浓度70%的硫酸d.亚硫酸钙和硝酸
(5)往BaCl2溶液中通入SO2至饱和,无明显现象,再通入NH3后出现白色沉淀,此时溶液中一定有的溶质是NH4Cl.请用电离平衡解释上述实验现象:SO2通入BaCl2溶液后,溶液中存在如下反应和电离:SO2+H2O?H2SO3,H2SO3?HSO3-+H+,HSO3-?H++SO32-,未通入NH3前溶液中SO32-的浓度较小,通入NH3后,H+浓度减小,平衡右移,SO32-的浓度增大,与Ba2+结合形成沉淀;
(6)H2O2是一种绿色氧化剂.某NH4Cl样品中含少量Fe2+、SO42-,将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,即得到工业氯化铵.滤渣的主要成分是BaSO4和Fe(OH)3.
分析 亚硫酸盐样品中加入稀硫酸之后,会发生反应得到二氧化硫气体,二氧化硫会被氮气完全排出,得到气体A是二氧化硫和氮气,二氧化硫具有还原性,能被双氧水氧化为硫酸,硫酸可以和氢氧化钠之间发生中和反应生成硫酸钠,
(1)亚硫酸根离子可以和强酸之间反应得到二氧化硫,氮气和二氧化硫之间不会反应;
(2)第①步反应是加入过氧化氢氧化二氧化硫伸出硫酸;
(3)滴定实验若选择酚酞作指示剂,氢氧化钠溶液滴定到最后一滴溶液变为粉红色且半分钟不变化说明反应达到终点,滴定过程中分析不当操作对V(标准)的影响,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$;
(4)实验室欲制取SO2可以利用铜和浓硫酸加热反应生成,亚硫酸钠固体和浓硫酸反应生成;
(5)往BaCl2溶液中通入SO2至饱和,无明显现象,再通入NH3后出现白色沉淀为亚硫酸钡沉淀,氨气和水生成一水合氨,二氧化硫和一水合氨反应生成亚硫酸铵盐,结合钡离子生成亚硫酸钡沉淀和氯化铵;
(6)加热有利于亚铁离子的氧化,且有利于铁离子的水解,再加入BaCl2溶液,得到硫酸钡沉淀;
解答 解:(1)亚硫酸盐样品中加入稀硫酸之后,会发生反应得到二氧化硫气体,氮气和二氧化硫之间不会反应,反应①中通入N2可以将生成的气体二氧化硫全部赶出,
故答案为:使反应产生的SO2气体充分逸出,减小实验误差;
(2)第①步反应的离子方程式是:SO2+H2O2=2H++SO42-,
故答案为:SO2+H2O2=2H++SO42-;
(3)滴定实验若选择酚酞作指示剂,则滴定终点的标志是溶液由无色变为粉红色,且半分钟内不褪色,
a.洗净的滴定管未用标准液润洗,标准溶液浓度减小,消耗体积增大,测定结果偏高,故a正确;
b.滴定中向锥形瓶内壁加少量水,对测定结果无影响,故b错误;
c.滴定前滴定管正常,滴定后尖嘴部分有气泡,读取标准溶液体积减小,测定结果偏低,故c错误;
d.锥形瓶用待测液洗涤2-3次,消耗标准溶液体积增大,测定结果偏高,故d正确;
故选ad,
故答案为:溶液由无色变为粉红色,且半分钟内不褪色;ad;
(4)a.铜和浓硫酸加热反应生成二氧化硫、硫酸铜和水,可以制备二氧化硫,故a正确;
b.硫和氧气点燃燃烧生成二氧化硫但不适用于实验室制备,故b错误;
c.亚硫酸钠和浓度70%的硫酸反应生成二氧化硫,可以制备二氧化硫气体,故c正确;
d.硝酸具有氧化性能氧化亚硫酸钠,亚硫酸钙和硝酸不能制备二氧化硫,故d错误;
故答案为:ac;
(5)往BaCl2溶液中通入SO2至饱和,无明显现象,再通入NH3后出现白色沉淀为亚硫酸钡沉淀,氨气和水生成一水合氨,二氧化硫和一水合氨反应生成亚硫酸铵盐,结合钡离子生成亚硫酸钡沉淀和氯化铵此时溶液中一定有的溶质是NH4Cl,电离平衡解释上述实验现象:SO2通入BaCl2溶液后,溶液中存在如下反应和电离:SO2+H2O?H2SO3,H2SO3?HSO3-+H+,HSO3-?H++SO32-,未通入NH3前溶液中SO32-的浓度较小,通入NH3后,H+浓度减小,平衡右移,SO32-的浓度增大,与Ba2+结合形成沉淀,
故答案为:NH4Cl;SO2通入BaCl2溶液后,溶液中存在如下反应和电离:SO2+H2O?H2SO3,H2SO3?HSO3-+H+,HSO3-?H++SO32-,未通入NH3前溶液中SO32-的浓度较小,通入NH3后,H+浓度减小,平衡右移,SO32-的浓度增大,与Ba2+结合形成沉淀;
(6)加热有利于亚铁离子的氧化,且有利于铁离子的水解,再加入BaCl2溶液,得到硫酸钡沉淀,滤渣的主要成分是氢氧化铁、硫酸钡,化学式为:Fe(OH)3、BaSO4,
故答案为:BaSO4和Fe(OH)3.
点评 本题考查了物质组成、物质性质、物质含量测定的实验过程分析,主要是物质性质和反应产物的判断,物质制备,掌握基础是解题关键,题目难度中等.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案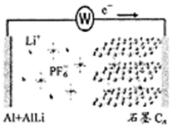 中科院深圳研究院成功开发出一种新型铝-石墨双离子电池,可大幅度提升电动汽车的使用性能,其工作原理如图所示.充电过程中,石墨电极发生阴离于插层反应,而铝电极发生铝-锂合金化反应,下列叙述正确的是( )
中科院深圳研究院成功开发出一种新型铝-石墨双离子电池,可大幅度提升电动汽车的使用性能,其工作原理如图所示.充电过程中,石墨电极发生阴离于插层反应,而铝电极发生铝-锂合金化反应,下列叙述正确的是( )| A. | 放电时,电解质中的Li+向左端电极移动 | |
| B. | 充电时,与外加电源负极相连一端电极反应为:AlLi-e-═Li++Al | |
| C. | 充电时,若转移0.2 mol电子,则铝电极上增重5.4 g | |
| D. | 放电时,正极反应式为CR(PF6)+e-═PF6-+CR |
| A. | 温度升高,水中分子总数减少 | B. | 水中c(OH-)随温度升高而降低 | ||
| C. | 水的pH随温度升高而升高 | D. | 水的电离过程是放热过程 |
| A. | 向0.2mol•L-1CH3COOH溶液中加入等体积0.1mol•L-1NaOH溶液,测得溶液中c(CH3COO-)>c(Na+),则水的电离程度比纯水的大 | |
| B. | 向0.1 mol•L-1氨水中滴加0.1 mol•L-1盐酸,刚好完全中和时溶液pH=a,则由水电离产生的c(OH-)=10a-14mol•L-1 | |
| C. | 将0.1 mol•L-1Na2CO3和0.1 mol•L-1NaHCO3溶液等体积混合,所得溶液有:c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3) | |
| D. | 对于难溶电解质:相同温度时,Ksp大的饱和溶液的物质的量浓度一定比Ksp小的饱和溶液物质的量浓度大 |
| 选项 | 环境要求 | 离子或分子 |
| A | Al2(SO4)3溶液中 | K+,AlO${\;}_{2}^{-}$,Cl-,NO${\;}_{3}^{-}$ |
| B | 滴加石蕊试液显蓝色的溶液中 | Na+,K-,SO${\;}_{3}^{2-}$,S2- |
| C | 水电离产生的c(OH-)=10-12mol•L-1的溶液 | ClO-,CO${\;}_{3}^{2-}$,NH${\;}_{4}^{+}$,K- |
| D | 氯气中 | O2,NH3,CO2,HCl |
| A. | A | B. | B | C. | C | D. | D |
| A. | 通过干馏可将煤中含有的苯、甲苯等物质分离出来 | |
| B. | 有机玻璃、聚酯纤维(涤纶)均由加聚反应生成 | |
| C. | 地沟油制得的生物柴油和裂化汽油都是烃 | |
| D. | 乙烯与氧气生成环氧乙烷原子利用率为100% |
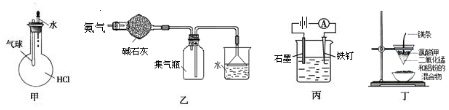
| A. | 如图装置甲:验证HCl气体在水中的溶解度大 | |
| B. | 如图装置乙:可干燥、收集氨气,并吸收多余的氨 | |
| C. | 如图装置丙:防止铁钉生锈 | |
| D. | 如图装置:可制得金属锰 |
| 编号 | 实验内容 | 实验目的 |
| A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
| B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
| C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe(OH)3胶体 |
| D | 往混有FeCl2的CuCl2溶液中加入H2O2 后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
| A. | A | B. | B | C. | C | D. | D |
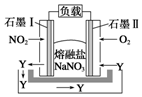 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.