题目内容
8.实验室常用的浓盐酸密度为1.17g•mL-1,质量分数为36.5%.将13g 锌投入足量 的上述实验所得的稀盐酸中,充分反应后,若将生成的H2通过足量的灼热CuO,求生成铜的质量为12.8g(假设氢气无损耗)分析 发生Zn+2HCl=ZnCl2+H2↑、H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,氢气无损耗,盐酸足量,则存在Zn~Cu,以此计算.
解答 解:氢气无损耗,盐酸足量,则Zn失去电子数等于Cu失去电子数,且Zn、Cu的化合价变化数相同,则二者的物质的量相同,生成铜的质量为$\frac{13g}{65g/mol}$×64g/mol=12.8g,
故答案为:12.8.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意Zn、Cu的物质的量相等,题目难度不大.

练习册系列答案
相关题目
18.已知:CH3C≡CH+CO+CH3OH$\stackrel{一定条件}{→}$X;X+H2O$\stackrel{一定条件}{→}$Y+CH3OH下列说法正确的是( )
| A. | X的分子式为C5H10O2 | |
| B. | X可能的结构有两种 | |
| C. | Y中含有的官能团有羧基和碳碳双键 | |
| D. | X与Y相对分子质量相差14,则X与Y互为同系物 |
19.可用碱石灰干燥的气体是( )
| A. | H2S | B. | Cl2 | C. | NH3 | D. | SO2 |
16.水的离子积常数随温度升高而升高.关于一定量的水,下列叙述正确的是( )
| A. | 温度升高,水中分子总数减少 | B. | 水中c(OH-)随温度升高而降低 | ||
| C. | 水的pH随温度升高而升高 | D. | 水的电离过程是放热过程 |
3.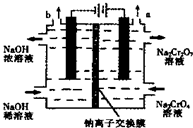 某工厂采用石墨电极电解Na2CrO4溶液,实现Na2CrO4到 Na2Cr2O7的转化,其装置如图所示.下列说法正确的是( )
某工厂采用石墨电极电解Na2CrO4溶液,实现Na2CrO4到 Na2Cr2O7的转化,其装置如图所示.下列说法正确的是( )
 某工厂采用石墨电极电解Na2CrO4溶液,实现Na2CrO4到 Na2Cr2O7的转化,其装置如图所示.下列说法正确的是( )
某工厂采用石墨电极电解Na2CrO4溶液,实现Na2CrO4到 Na2Cr2O7的转化,其装置如图所示.下列说法正确的是( )| A. | 阳极区的pH会不断下降 | |
| B. | 溶液中Na+从阴极移向阳极 | |
| C. | 该电解池的两电极材料只能用石墨不能用铁 | |
| D. | 阳极区发生的反应是:2H2O-4e-═O2↑+4H+,2CrO42-+2H+═Cr2O72-+H2O |
20.有关电解质溶液的叙述正确的是( )
| A. | 向0.2mol•L-1CH3COOH溶液中加入等体积0.1mol•L-1NaOH溶液,测得溶液中c(CH3COO-)>c(Na+),则水的电离程度比纯水的大 | |
| B. | 向0.1 mol•L-1氨水中滴加0.1 mol•L-1盐酸,刚好完全中和时溶液pH=a,则由水电离产生的c(OH-)=10a-14mol•L-1 | |
| C. | 将0.1 mol•L-1Na2CO3和0.1 mol•L-1NaHCO3溶液等体积混合,所得溶液有:c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3) | |
| D. | 对于难溶电解质:相同温度时,Ksp大的饱和溶液的物质的量浓度一定比Ksp小的饱和溶液物质的量浓度大 |
17.下列说法正确的是( )
| A. | 通过干馏可将煤中含有的苯、甲苯等物质分离出来 | |
| B. | 有机玻璃、聚酯纤维(涤纶)均由加聚反应生成 | |
| C. | 地沟油制得的生物柴油和裂化汽油都是烃 | |
| D. | 乙烯与氧气生成环氧乙烷原子利用率为100% |
18.有机化学与材料、生活和环境密切相关.下列说法正确的是( )
| A. | 利用植物秸秆可以生产香料乙酸乙酯 | |
| B. | 从煤焦油中提取苯和苯的同系物,可采取的方法是萃取 | |
| C. | 用石油裂解产物通过加聚反应直接制备PVC(聚氯乙烯) | |
| D. | 油脂在氢氧化钠溶液中加热发生皂化反应,最终生成高级脂肪酸和丙三醇 |
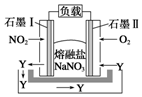 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.