题目内容
1.下列微粒半径由大到小的排列是( )| A. | Ca,Mg,Na | B. | Cl-,S2-,O2- | C. | P3-,S2-,Cl- | D. | K+、Cl-,S2- |
分析 一般来讲,离子(或原子)的电子层越多,离子(或原子)半径越大,电子层相同时,离子(或原子)的核电荷数越大,其半径越小,据此对各选项进行判断.
解答 解:A.Mg、Na的电子层数相同,Na的核电荷数较小,则原子半径:Na>Mg,故A错误;
B.S2-、Cl-的电子层数相同,核电荷数逐渐增大,则离子半径逐渐减小,即离子半径:S2->Cl-,故B错误;
C.P3-、S2-、Cl-的电子层数相同,核电荷数逐渐增大,则离子半径逐渐减小,即离子半径从大到小的顺序为:P3-、S2-、Cl-,故C正确;
D.K+、Cl-、S2-的电子层数都是3,核电荷数越大,离子半径越小,则离子半径:S2->Cl-,故D错误;
故选C.
点评 本题考查微粒半径大小比较,题目难度不大,明确粒子比较与电子层数、核电荷数、核外电子总数之间的关系为解答关键,注意对元素周期律的理解掌握,试题培养了学生的灵活应用能力.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
12.下列有关第三周期元素的性质递变的说法错误的是( )
| A. | 从左到右,金属性减弱 | B. | 从左到右,非金属性增强 | ||
| C. | 从左到右,正化合价的数值增大 | D. | 从左到右,原子半径逐渐增大 |
16.水的离子积常数随温度升高而升高.关于一定量的水,下列叙述正确的是( )
| A. | 温度升高,水中分子总数减少 | B. | 水中c(OH-)随温度升高而降低 | ||
| C. | 水的pH随温度升高而升高 | D. | 水的电离过程是放热过程 |
6.下列有关化学实验安全的叙述中正确的是( )
| A. | 点燃的酒精灯不小心打碎了,可直接用自来水灭火 | |
| B. | 点燃氢气前先验纯 | |
| C. | 蒸发食盐溶液时,发生液滴飞溅现象,应立即加水冷却 | |
| D. | 在实验室可以用口尝来鉴别化学药品 |
10.下列离子或分子组中,在相应的环境中一定能大量共存的是( )
| 选项 | 环境要求 | 离子或分子 |
| A | Al2(SO4)3溶液中 | K+,AlO${\;}_{2}^{-}$,Cl-,NO${\;}_{3}^{-}$ |
| B | 滴加石蕊试液显蓝色的溶液中 | Na+,K-,SO${\;}_{3}^{2-}$,S2- |
| C | 水电离产生的c(OH-)=10-12mol•L-1的溶液 | ClO-,CO${\;}_{3}^{2-}$,NH${\;}_{4}^{+}$,K- |
| D | 氯气中 | O2,NH3,CO2,HCl |
| A. | A | B. | B | C. | C | D. | D |
11.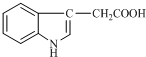 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )| A. | 吲哚乙酸的分子式是C10H10NO2 | |
| B. | 吲哚乙酸苯环上的二氯代物共有四种(不考虑立体异构) | |
| C. | 吲哚乙酸可以发生取代反应、加成反应、氧化反应和还原反应 | |
| D. | 1 mol吲哚乙酸与足量氢气发生加成反应时,可以消耗5 mol H2 |
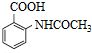 的合成路线流程图(无机试剂任用).合成路线流程图示例:CH2CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br$→_{△}^{NaOH水溶液}$CH2OHCH2OH
的合成路线流程图(无机试剂任用).合成路线流程图示例:CH2CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br$→_{△}^{NaOH水溶液}$CH2OHCH2OH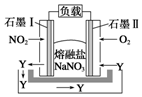 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.