题目内容
14.锡是第IVA族金属元素,常见化合价为+2、+4价,其单质及化合物在生活、生产中有重要应用.已知:Sn熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点-33℃、沸点114℃.请按要求回答下列相关问题:(1)如图为锡原子结构示意图
 ,请补充完整:
,请补充完整:(2)用于微电子器件生产的锡粉纯度测定:
①取2.38g试样溶于较浓硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.2000mol•L-1K2Cr2O7溶液滴定步骤②得到的溶液(产物中Cr呈+3价),消耗25,.00mL.步骤②中加入Fe2(SO4)3发生反应的离子方程式为2Fe3++Sn2+=2Fe2++Sn4+;此锡粉样品中锡的质量分数为75%.
(3)实验室配制SnCl2溶液时:要先将SnCl2固体少量浓盐酸,并在新配制的SnCl2溶液中加入锡粉,目的是防止其水解及发生氧化反应.
(4)SnO不溶于水,工业上常用于制备SnSO4.向酸性SnCl2溶液中加入碳酸氢铵溶液调 PH=7,可以生成SnO,写出反应的离子方程式Sn2++2HCO3-=SnO↓+2CO2↑+H2O.
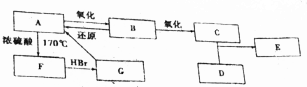
(5)现有如图下列装置,某化学实验小组要在实验室中制备少量SnCl4,请回答下列问题:

①所选择的仪器装置及合理的先后排列顺序是:A→C→E→B→G→D→H→F.
②实验中当开始生成SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是锡与氯气的反应为放热反应.
分析 (1)锡为50号元素,根据核外电子排布规律可知其原子核外电子排布;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,同时生成Fe2+,根据元素守恒及电子得失守恒有关系式3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7,根据K2Cr2O7的物质的量可计算出锡的物质的量,进而求得锡的质量,据此确定锡的质量分数;
(3)Sn2+易水解、易被氧化,所以实验室配制SnCl2溶液时要防止其水解及发生氧化反应,据此答题;
(4)向酸性SnCl2溶液中加入碳酸氢铵溶液调 PH=7,可以生成SnO,同时还有二氧化碳和氯化铵生成,根据电荷守恒和元素守恒书写离子方程式;
(5)SnCl4极易水解,反应应在无水环境下进行进行,A中发生反应:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,所以要用饱和食盐水除去HCl,可以降低氯气的溶解,浓硫酸吸收水蒸气,干燥氯气,氯气与Sn在B中反应生成SnCl4,经冷凝后用H装置进行收集SnCl4,未反应的氯气,用干燥管中碱石灰吸收,同时又可以防止空气中的水分进入H中使产物水解,以此解答该题.
解答 解:(1)锡为50号元素,质子数为50,根据核外电子排布规律可知其原子核外电子排布为2、8、18、18、4,原子结构示意图为 ,
,
故答案为: ;
;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,同时生成Fe2+,反应的离子方程式为2Fe3++Sn2+=2Fe2++Sn4+,根据元素守恒及电子得失守恒有关系式3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7,K2Cr2O7的物质的量为0.2000mol•L-1×0.025L=0.005mol,所以锡的物质的量为0.015mol,则锡的质量分数为$\frac{0.015mol×119g/mol}{2.38g}$×100%=75%,
故答案为:2Fe3++Sn2+=2Fe2++Sn4+;75%;
(3)Sn2+易水解、易被氧化,所以实验室配制SnCl2溶液时要防止其水解及发生氧化反应,要先将SnCl2固体溶于少量浓盐酸中,并在新配制的SnCl2溶液中加入少量锡粉,
故答案为:少量浓盐酸;锡粉;防止其水解及发生氧化反应;
(4)向酸性SnCl2溶液中加入碳酸氢铵溶液调 PH=7,可以生成SnO,同时还有二氧化碳和氯化铵生成,反应的离子方程式为Sn2++2HCO3-=SnO↓+2CO2↑+H2O,
故答案为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O;
(5)SnCl4极易水解,反应应在无水环境下进行进行,A中发生反应:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,所以要用饱和食盐水除去HCl,可以降低氯气的溶解,浓硫酸吸收水蒸气,干燥氯气,氯气与Sn在B中反应生成SnCl4,经冷凝后用H装置进行收集SnCl4,未反应的氯气,用干燥管中碱石灰吸收,同时又可以防止空气中的水分进入H中使产物水解,
①根据上面的分析可知,仪器装置及合理的先后排列顺序是A→C→E→B→G→D→H→F,
故答案为:C→E→B→G→D→H→F;
②由于锡与氯气的反应为放热反应,所以当开始生成SnCl4时即可熄灭B处酒精灯,反应仍可持续进行,
故答案为:锡与氯气的反应为放热反应.
点评 本题考查物质制备方案、化学工艺流程、物质含量测定、原子结构等知识,是对学生综合能力的考查,需要学生具备扎实的基础与良好的心理素质,难度中等.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案| A. | 氢氟酸易与SiO2反应,可用于刻蚀玻璃 | |
| B. | Al和Fe2O3能发生铝热反应,可用于焊接钢轨 | |
| C. | NH3具有碱性,可用NH3与灼热的CuO作用制取少量N2 | |
| D. | Fe具有良好的导电性,可用Fe作电解食盐水的阴极材料 |
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸.
| A. | ①②③ | B. | ①②④ | C. | ②③ | D. | ①③⑤ |
| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | 为提高反应速率,可换用98%的浓硫酸 | |
| B. | 在反应过程中,水的电离程度逐渐增大 | |
| C. | 在反应体系中加入硫酸钠溶液,反应速率不变 | |
| D. | 在反应体系中加入少量醋酸钠固体,反应速率变慢,生成氢气的量减少 |