题目内容
9.为了检验某固体物质中是否含有NH4+,你认为下列试纸和试剂用到的是( )①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸.
| A. | ①②③ | B. | ①②④ | C. | ②③ | D. | ①③⑤ |
分析 铵根离子与碱反应生成氨气,氨气能使红色石蕊试纸变蓝,以此来解答.
解答 解:铵根离子和氢氧化钠溶液反应生成氨气,所以生成氨气需要②NaOH溶液,氨气能使湿润的红色石蕊试纸变蓝色,则需要③红色石蕊试纸,且需要蒸馏水润湿试纸,则不需要的物质是蓝色石蕊试纸及稀硫酸,
故选A.
点评 本题考查物质的检验和鉴别,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握氨气的性质及检验方法,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
19.用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示.下列说法正确的是( )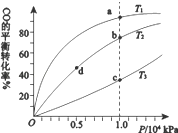

| A. | 温度:T1>T2>T3 | B. | 正反应速率:v(b)>υ(d)v(a)>υ(c) | ||
| C. | 平衡常数:K(a)>K(c) K(b)=K(d) | D. | 平均摩尔质量:M(b)>M(d)M(a)<M(c) |
20.用NA表示阿佛加德罗常数的值,下列说法中正确的是( )
| A. | 1mol甲烷的质量与NA个甲烷分子的质量之和相等 | |
| B. | 28g氮气与40g氩气所含的原子数目相等,都是NA个 | |
| C. | 2.3g钠由原子变成离子,失去的电子数为0.1个 | |
| D. | 18g重水(D2O)所含的电子数为10NA |
17.将一定量的Cl2通入体积为40mL、浓度为7.5mol/L的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),测得反应后溶液中有三种含氯元素的离子,其中ClO-物质的量为0.06mol和ClO3-物质的量0.03mol,下列说法不正确的是( )
| A. | 该反应的离子方程式为:5Cl2+10 OH-═7Cl-+2ClO-+ClO3-+5H2O | |
| B. | 该反应中,氧化剂与还原剂物质的量之比为5:3 | |
| C. | 上述苛性钾溶液中含有0.3mol的KOH | |
| D. | 反应后生成的ClO-和 ClO3- 两种离子在一定条件下均有氧化性 |
4.甲、乙、丙、丁分别是氢氧化钡溶液、氯化钾溶液、碳酸钠溶液、硝酸中的一种.已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是( )
| A. | 乙一定是氯化钾溶液 | B. | 甲一定是氢氧化钡溶液 | ||
| C. | 丙不可能是碳酸钠溶液 | D. | 丁只能是硝酸 |
8.如图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )

| A. | ①②③④⑤ | B. | ③②①⑤④ | C. | ⑤①③②④ | D. | ⑤②①③④ |
 ,请补充完整:
,请补充完整:
