题目内容
4.根据不同价态铁元素之间的相互转化关系,回答下列问题:(1)配制含Fe2+的溶液时,常常向溶液中加入少量铁粉,使被氧气氧化形成的Fe3+还原为Fe2+.
(2)为除去废水中的Fe2+,常先将废水中的Fe2+氧化为Fe3+,再根据Fe3+的性质使Fe3+转化为红褐色的Fe(OH)3沉淀析出.
(3)在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应.反应的离子方程式为Cu+2Fe3+═Cu2++2Fe2+.
(4)为消除废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2溶液,即可有效地除去Cl2,这一处理过程可用两个离子方程式表示为Cl2+2Fe2+═2Fe3++2Cl-,Fe+2Fe3+═3Fe2+;
处理过程中需定期添加的原料是Fe粉.
分析 (1)配制硫酸亚铁溶液时,利用还原剂防止亚铁离子被氧化,且不能引入新杂质;
(2)为除去废水中的Fe2+,常先将废水中的Fe2+氧化为铁离子,铁离子极易转化为氢氧化铁沉淀,由此分析解答;
(3)FeCl3溶液与金属铜反应,生成氯化亚铁、氯化铜;
(4)Cl2与FeCl2溶液反应生成FeCl3,铁粉与FeCl3反应生成FeCl2,据此分析.
解答 解:(1)配制硫酸亚铁溶液时,利用还原剂防止亚铁离子被氧化,且不能引入新杂质,则加入铁粉(铁钉也可)以防止Fe2+被氧化,故答案为:铁粉(铁钉也可);(2)为除去废水中的Fe2+,常先将废水中的Fe2+氧化为铁离子,铁离子极易转化为氢氧化铁沉淀,故答案为:Fe3+;Fe(OH)3;
(3)FeCl3溶液与金属铜反应,生成氯化亚铁、氯化铜,化学反应为2FeCl3+Cu═2FeCl2+CuCl2,所以离子反应方程式为:Cu+2Fe3+═Cu2++2Fe2+,故答案为:Cu+2Fe3+═Cu2++2Fe2+;
(4)Cl2与FeCl2溶液反应生成FeCl3,其反应的化学方程式为:2FeCl2+Cl2=2FeCl3,离子反应方程式为:Cl2+2Fe2+═2Fe3++2Cl-,铁粉与FeCl3反应生成FeCl2其反应的化学方程式为:2FeCl3+Fe=3FeCl2,离子反应方程式为:Fe+2Fe3+═3Fe2+,根据两个反应可知,处理过程中消耗的原料是铁粉,
故答案为:Cl2+2Fe2+═2Fe3++2Cl-;Fe+2Fe3+═3Fe2+;Fe粉.
点评 本题考查金属及其化合物的性质,为高频考点,把握铁及其化合物、铜的性质及发生的氧化还原反应为解答的关键,侧重分析与应用能力的考查,综合性较强,涉及离子反应、化学反应及混合物分离提纯等,题目难度不大.

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案| A. | 硝是指硝酸 | B. | 黑火药爆炸是氧化还原反应 | ||
| C. | 木炭在反应中做还原剂 | D. | 反应放热并产生大量气体 |
| A. | 盐酸滴在石灰石上:CO32-+2H+═H2O+CO2↑ | |
| B. | 少量CO2通入氢氧化钠溶液中:2OH-+CO2═CO32-+H2O | |
| C. | NaOH溶液和NaHSO4溶液反应:HSO4-+OH-═SO42+H2O | |
| D. | 稀H2SO4滴在铜片上:Cu+2H+═Cu2++H2↑ |
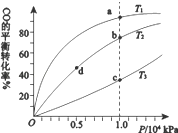
| A. | 温度:T1>T2>T3 | B. | 正反应速率:v(b)>υ(d)v(a)>υ(c) | ||
| C. | 平衡常数:K(a)>K(c) K(b)=K(d) | D. | 平均摩尔质量:M(b)>M(d)M(a)<M(c) |
| A. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 实验室用NH4Cl和Ca(OH)2制备NH3涉及氧化还原反应 | |
| D. | 将分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
| A. | 在密闭容器中加入1mol N2和3mol H2,充分反应生成NH3分子数为2NA | |
| B. | 0.1mol-NH2(氨基)中含有的电子数为0.7NA | |
| C. | 30g SiO2中含有的Si-O键数目为2NA | |
| D. | 标准状况下,4.48 L N2所含的共用电子对数0.2NA |
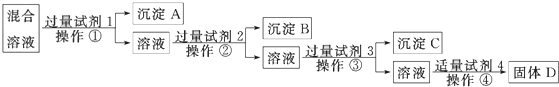
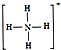 ,白磷(P4)的结构式为
,白磷(P4)的结构式为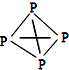 ,请画出N4H44+的结构式
,请画出N4H44+的结构式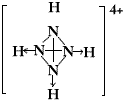 .
. ,请补充完整:
,请补充完整: