题目内容
16.下列变化需要克服共价键的是( )| A. | 干冰的升华 | B. | 硅的熔化 | C. | 氯化钾的溶解 | D. | 汞的气化 |
分析 原子晶体熔化克服共价键,离子晶体熔化或电离均克服离子键,分子晶体发生三态变化只破坏分子间作用力,非电解质溶于水不发生电离,则不破坏化学键,以此来解答.
解答 解;A.干冰的升华克服分子间作用力,故A错误;
B.硅为原子晶体,只存在共价键,熔化时克服共价键,故B正确;
C.氯化钾为离子晶体,溶于水发生电离,克服离子键,故C错误;
D.汞受热变成汞蒸气,克服金属键,故D错误.
故选B.
点评 本题考查化学键及分子间作用力,把握物质的晶体类型、存在的化学键及电解质、非电解质为解答的关键,注意三态变化只克服分子间作用力,题目难度不大.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
6.下列说法不正确的是( )
| A. | 0.02 mol•L-1醋酸与0.02 mol•L-1NaOH等体积混合后的溶液中加少量的CH3COONa固体,则$\frac{c(C{H}_{3}CO{O}^{-})}{C(N{a}^{+})}$ 增大 | |
| B. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO)•c(S{O}_{3})}{c(N{O}_{2})•c(S{O}_{2})}$ 的值及SO2转化率不变 | |
| C. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | lmol该化合物( 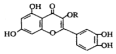 )与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4mol、8mol )与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4mol、8mol |
7.乙醇与酸性K2Cr2O7溶液混合可发生如下反应:Cr2O72-+C2H5OH+H+=Cr3++CH3COOH+H2O(未配平).下列叙述不正确的是( )
| A. | Cr2O72-中Cr元素化合价为+6 | |
| B. | 氧化产物为CH3COOH | |
| C. | K2Cr2O7溶液常用硫酸酸化 | |
| D. | lmol C2H5OH发生上述反应转移2mole- |
4.下列说法正确的是( )
| A. | 制氢弹用到的D、T互为同位素 | |
| B. | 苛性钠溶液可用于治疗胃酸过多 | |
| C. | 硅胶可防止月饼等食品氧化变质 | |
| D. | 向海水中加入净水剂明矾可以使海水淡化 |
11.下列说法中不正确的是( )
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则b<a-1 | |
| B. | pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<① | |
| C. | 某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则 2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×1037 | |
| D. | 一定浓度的 NaHS 溶液中:c(Na+)+c(OH-)═c(H+)+c(HS-)+2c(H2S) |
8.将5.000g的碳酸钠和碳酸氢钠的混合物进行加热,加热至质量不再减少时,混合物的质量减少了0.310g,则原混合物中碳酸钠的质量为( )
| A. | 3.380g | B. | 4.580g | C. | 4.160g | D. | 4.410g |
5.已知:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O.实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体.当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种.下列说法正确的是( )
| A. | 若产物为NaClO、NaCl,则吸收后的溶液中n(ClO-)═n(Cl-) | |
| B. | 若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1:5 | |
| C. | 若产物为NaClO、NaClO3、NaCl,则由吸收后溶液中n(Cl-)和n(ClO3-)可计算吸收的n(Cl2) | |
| D. | 若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比一定为2:1 |
18.液体H2O2中不存在的作用力是( )
| A. | 极性键 | B. | 非极性键 | C. | 离子键 | D. | 氢键 |