题目内容
11.下列说法中不正确的是( )| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则b<a-1 | |
| B. | pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<① | |
| C. | 某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则 2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×1037 | |
| D. | 一定浓度的 NaHS 溶液中:c(Na+)+c(OH-)═c(H+)+c(HS-)+2c(H2S) |
分析 A.一水合氨为弱电解质,加水稀释促进电离;
B.①CH3COONa ②NaHCO3 ③NaClO三种溶液,水解程度③>②>①,pH相同时水解程度越大对应浓度越小;
C.2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数K=$\frac{{c}^{2}(C{l}^{-})}{c({S}^{2-})}$=$\frac{{c}^{2}(C{l}^{-})}{c({S}^{2-})}$×$\frac{{c}^{2}(A{g}^{+})}{{c}^{2}(A{g}^{+})}$=$\frac{Ks{p}^{2}(AgCl)}{Ksp(A{g}_{2}S)}$;
D.一定浓度的 NaHS 溶液中存在电荷守恒和物料守恒计算分析.
解答 解:A.一水合氨为弱电解质,加水稀释促进电离,b>a-1,故A错误;
B.①CH3COONa ②NaHCO3 ③NaClO三种溶液,水解程度③>②>①,pH相同时水解程度越大对应浓度越小,pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<①,故B正确;
C.2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数K=$\frac{{c}^{2}(C{l}^{-})}{c({S}^{2-})}$=$\frac{{c}^{2}(C{l}^{-})}{c({S}^{2-})}$×$\frac{{c}^{2}(A{g}^{+})}{{c}^{2}(A{g}^{+})}$=$\frac{Ks{p}^{2}(AgCl)}{Ksp(A{g}_{2}S)}$=$\frac{(2×1{0}^{-6})^{2}}{6×1{0}^{-50}}$=6.7×1037,故C正确;
D.一定浓度的 NaHS 溶液中存在电荷守恒和物料守恒:电荷守恒c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),物料守恒c(Na+)=c(HS-)+c(S2-)+c(H2S),得到c(Na+)+c(OH-)═c(H+)+c(HS-)+2c(H2S),故D正确;
故选A.
点评 本题考查了弱电解质电离平衡、电离平衡影响因素、溶度积常数计算,电解质溶液中物料守恒和电荷守恒的计算,掌握基础是解题关键,题目难度中等.

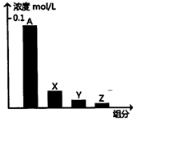 常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | A可能表示Na+ | |
| B. | A可能表示乙酸分子 | |
| C. | 若图中A表示CH3COO-,可以证明乙酸是弱酸 | |
| D. | 该混合溶液中:c(A)+c(Y)=c(X)+c(Z) |
| A. | 呈弱酸性 | |
| B. | c(OH-)+c(NH3•H2O)=c(H+)+c(H2CO3) | |
| C. | 滴入NaOH 溶液发生反应:NH4++OH-=NH3•H2O和HCO3-+OH-=H2O+CO32- | |
| D. | 滴入NaOH溶液,则$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$增大 |
| A. | 100g 98%的浓硫酸中含有的氢原子数目为2NA | |
| B. | 16g16O2和18O2的混合物中含有的质子数目为8NA | |
| C. | 电解精炼铜的过程中,若阳极减重64g,则电路中一定通过2NA个电子 | |
| D. | 取50ml14.0mol/L浓硝酸与足量的铜片反应,生成气体分子的数目可能为0.25NA |
| 选项 | 现象或事实 | 解释 |
| A | 化石燃料燃烧时采取脱硫措施 | 提高化石燃料的利用率 |
| B | 食品袋中常放有硅胶和铁粉,都能起到干燥的作用 | 二者都有较强的吸水性 |
| C | 高温加热能杀死流感病毒 | 蛋白质受热变性 |
| D | 高铁车厢采用铝合金材料 | 铝和氧气不反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 干冰的升华 | B. | 硅的熔化 | C. | 氯化钾的溶解 | D. | 汞的气化 |
| A. | H2O | B. | Br2 | C. | CH4 | D. | HCl |
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2SO4 | D. | NaCl |