题目内容
1.铁、铝是生活中常见的重要金属材料.高温下炼铁的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)-Q
(1)写出该反应的平衡常数的表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$.当混合气体的质量、平均分子量、密度(填物理量名称)不变时,表明上述反应已达到平衡.
(2)写出一种能提高上述反应中氧化铁转化率的措施升高温度、提高一氧化碳的浓度、及时移走二氧化碳等.取一定量铝热剂,在高温下进行铝热反应:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(3)请标出电子转移的方向和数目.若反应中有 1.5mol 电子转移,可得到铁28g.
(4)将铝热剂直接加到足量氢氧化钠溶液中,有气体生成.请写出该现象对应的离子方程式.2Al+2H2O+2OH-=2AlO2-+3H2↑
(5)若将铝热反应后所得固体用足量盐酸溶解,并加入硫氰化钾溶液,溶液不变血红色.据此能否确认固体中已不含氧化铁?说明理由.不能确认,因为所得固体中有铁,会将 Fe3+还原为 Fe2+.
分析 (1)平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积;未反应时是变量现不变说明达平衡状态;
(2)提高氧化铁的转化率,则平衡正向移动,所以可以通过升高温度、提高一氧化碳的浓度、及时移走二氧化碳等方法;
(3)一氧化碳是还原剂,而氧化铁中铁化合价降低是氧化剂,所以电子转移的方向和数目表示为: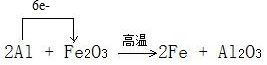 ,由反应方程式可知,生成1mol铁转移3mol的电子,所以有 1.5mol 电子转移生成0.5mol的铁;
,由反应方程式可知,生成1mol铁转移3mol的电子,所以有 1.5mol 电子转移生成0.5mol的铁;
(4)将铝热剂直接加到足量氢氧化钠溶液中,铝与氢氧化钠反应生成偏铝酸钠和氢气;
(5)将铝热反应后所得固体用足量盐酸溶解,并加入硫氰化钾溶液,溶液不变血红色说明无铁离子,而固体中有铁,会将 Fe3+还原为 Fe2+,所以不能确认,是否含氧化铁.
解答 解:(1)平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积,所以K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$;未平衡时质量、平均分子量、密度等都随时间的变化而变化,如果气体的质量、平均分子量、密度不再随时间的变化而变化说明达平衡状态,故答案为:K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$;质量、平均分子量、密度;
(2)提高氧化铁的转化率,则平衡正向移动,所以可以通过升高温度、提高一氧化碳的浓度、及时移走二氧化碳等方法,故答案为:升高温度、提高一氧化碳的浓度、及时移走二氧化碳等;
(3)一氧化碳是还原剂,而氧化铁中铁化合价降低是氧化剂,所以电子转移的方向和数目表示为: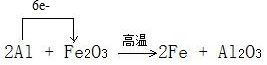 ,由反应方程式可知,生成1mol铁转移3mol的电子,所以有 1.5mol 电子转移生成0.5mol的铁,质量为28g,故答案为:
,由反应方程式可知,生成1mol铁转移3mol的电子,所以有 1.5mol 电子转移生成0.5mol的铁,质量为28g,故答案为: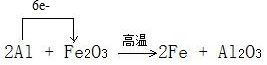 ;28;
;28;
(4)将铝热剂直接加到足量氢氧化钠溶液中,铝与氢氧化钠反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(5)将铝热反应后所得固体用足量盐酸溶解,并加入硫氰化钾溶液,溶液不变血红色说明无铁离子,而固体中有铁,会将 Fe3+还原为 Fe2+,所以不能确认,是否含氧化铁,故答案为:不能确认,因为所得固体中有铁,会将 Fe3+还原为 Fe2+.
点评 本题考查了 铁及其化合物性质的分析判断,氧化还原反应电子的转移,注意铝和氢氧化钠反应生成偏铝酸钠与氢气,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 氰化钾中含有离子键和极性键 | |
| B. | 氰化钾中碳元素的化合价为+4价 | |
| C. | KCN与KMnO4溶液反应可能生成CO2和N2 | |
| D. | 相同条件下,KCN溶液的碱性强于CH3COOK溶液 |
| A. |  制备纯氯气 | B. |  探究X、Y金属活泼性强弱 | ||
| C. |  证明H2CO3酸性比H2SiO3强 | D. |  制备无水氯化铁 |
| A. | 干冰的升华 | B. | 硅的熔化 | C. | 氯化钾的溶解 | D. | 汞的气化 |
| A. | 铜粉加入硝酸中 | B. | 溴化亚铁溶液中通氯气 | ||
| C. | AlCl3溶液中滴入NaOH 溶液 | D. | 铁粉在硫蒸气中燃烧 |
| A. | 氯化铝、氨水 | B. | 氢硫酸、氧气 | C. | 硫酸铝、氢氧化钠 | D. | 氯化亚铁、氯气 |
| A. | 冰融化时,分子中H-O键发生断裂 | |
| B. | 由于H-O键比H-S键牢固,所以水的熔沸点比H2S高 | |
| C. | 在由分子所构成的物质中,分子间作用力越大,该物质越稳定 | |
| D. | 随着电子层数的增加,卤单质X2分子间作用力逐渐增大,熔沸点逐渐升高 |