题目内容
19.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的正极反应式为MnO2+e-+H+═MnOOH,电池反应的离子方程式为:Zn+2MnO2+2H+═Zn2++2MnOOH
(2)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
分析 (1)该电池的正极发生还原反应,MnO2被还原生成MnOOH;负极锌被氧化生成Zn2+,以此书写电池总反应式;
(2)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol•L-1,结合Ksp=10-39计算pH,并根据Ksp计算锌开始沉淀的pH.
解答 解:(1)该电池的正极发生还原反应,MnO2被还原生成MnOOH,电极方程式为MnO2+H++e-=MnOOH,负极锌被氧化生成Zn2+,电池总反应式为2MnO2+Zn+2H+=2MnOOH+Zn2+,
故答案为:MnO2+e-+H+═MnOOH;Zn+2MnO2+2H+═Zn2++2MnOOH;
(2)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol•L-1,因Ksp=10-39,
则c(OH-)=$\root{3}{\frac{1{0}^{-39}}{1×1{0}^{-5}}}$mol/L≈0.5×10-11mol/L,此时pH=2.7,如锌开始沉淀,则c(OH-)=$\sqrt{\frac{1{0}^{-17}}{0.1}}$mol/L=10-8mol/L,此时pH=6,由表中数据可知Zn(OH)2、Fe(OH)2的Ksp相近,如不加H2O2,则Zn2+和Fe2+分离不开,
故答案为:Fe3+;2.7;6;Zn2+和Fe2+分离不开;Fe(OH)2和Zn(OH)2的Ksp相近.
点评 本题考查原电池知识以及物质的分离、提纯,侧重于原电池的工作原理以及实验基本操作和注意问题,题目难度中等,有利于培养学生良好的科学素养.

练习册系列答案
相关题目
9.在铜的冶炼过程中有如下反应发生:5FeS2+14CuSO4+12H2O═7Cu2S+5FeSO4+12H2SO4关于此反应,下列说法正确的是( )
| A. | Cu2S是氧化产物 | |
| B. | 14molCuSO4发生反应,有11mol电子转移 | |
| C. | FeS2中S显-2价 | |
| D. | 若有7molCuSO4发生反应,则被其氧化的S原子为1mol |
10.下列有关物质的性质和该性质的应用均正确的是( )
| A. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| B. | NaHCO3能与碱反应,食品工业上用作焙制糕点的膨松剂 | |
| C. | Mg(OH)2分解吸热且生成高熔点固体,可用作阻燃剂 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
4.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图.下列说法不正确的是( )
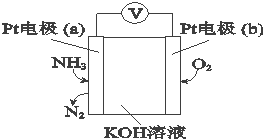

| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极a移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为3:4 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-═N2+6H2O |
11.某原电池的总反应为:Cu+2Fe3+═Cu2++2Fe2+( )
| A | B | C | D | |
| 电极材料 | Cu、Zn | Cu、Ag | Fe、Zn | Cu、C |
| 插入溶液 | FeCl3 | Fe(NO3) 2 | CuSO4 | Fe2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
8.咖啡酸的结构如图所示.关于咖啡酸的描述不正确的是( )


| A. | 分子式为C9H8O4 | |
| B. | 1mol咖啡酸最多能与4mol氢气发生加成反应 | |
| C. | 遇溴水,既能发生取代反应又能发生加成反应 | |
| D. | 能还原酸性KMnO4溶液,说明其分子中含有碳碳双键 |

 ;
;