题目内容
9.在铜的冶炼过程中有如下反应发生:5FeS2+14CuSO4+12H2O═7Cu2S+5FeSO4+12H2SO4关于此反应,下列说法正确的是( )| A. | Cu2S是氧化产物 | |
| B. | 14molCuSO4发生反应,有11mol电子转移 | |
| C. | FeS2中S显-2价 | |
| D. | 若有7molCuSO4发生反应,则被其氧化的S原子为1mol |
分析 反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4中,Cu元素化合价降低,被还原,CuSO4为氧化剂,FeS2中S元素化合价为-1价,反应后分别升高为+6价、降低为-2价,FeS2既是氧化剂又是还原剂,从元素化合价的角度判断并计算该题.
解答 解:A.反应中Cu元素的化合价降低,硫化亚铜中的硫是由硫化亚铁中-1价的硫降低到-2价,则Cu2S只是还原产产物,故A错误;
B.由方程式可知14molCuSO4发生反应,有3molS被氧化,化合价由-1价升高到+6价,则转移电子21mol,故B错误;
C.FeS2中S显-1价,故C错误;
D.由若有7molCuSO4发生反应,Cu元素化合价由+2价降低为+1价,可得到7mol电子,S元素化合价由-1价升高到+6价,则被其氧化的S原子为1mol,故D正确.
故选D.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,注意把握元素化合价的判断,从化合价变化的角度分析,题目难度中等.

练习册系列答案
相关题目
17.在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe $\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2═Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
4.标准状况下,448mL的某气体质量为1.28g,则该气体可能是下列中的( )
| A. | 二氧化碳 | B. | 氯气 | C. | 氨气 | D. | 二氧化硫 |
1.NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 1mol Cl2在反应中得到电子数不一定为NA | |
| B. | 1mol O2在反应中得到电子数一定为4NA | |
| C. | 1molNa2O2与足量H2O反应,转移了NA个电子 | |
| D. | 在2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O中,氯气既是氧化产物又是还原产物 |
18.下列离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | 澄清石灰水与过量苏打溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 碘化亚铁中通入氯气:2I-+Cl2═I2+2Cl- |
19.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
回答下列问题:
(1)该电池的正极反应式为MnO2+e-+H+═MnOOH,电池反应的离子方程式为:Zn+2MnO2+2H+═Zn2++2MnOOH
(2)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的正极反应式为MnO2+e-+H+═MnOOH,电池反应的离子方程式为:Zn+2MnO2+2H+═Zn2++2MnOOH
(2)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
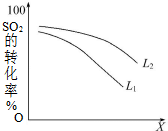 一定温度下,在2L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1
一定温度下,在2L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1 两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题.A管中是Fe+H2SO4,B管中是NaOH溶液
两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题.A管中是Fe+H2SO4,B管中是NaOH溶液