题目内容
10.下列有关物质的性质和该性质的应用均正确的是( )| A. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| B. | NaHCO3能与碱反应,食品工业上用作焙制糕点的膨松剂 | |
| C. | Mg(OH)2分解吸热且生成高熔点固体,可用作阻燃剂 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
分析 A.氯化铁与氨水反应生成氢氧化铁沉淀;
B.碳酸氢钠不稳定,加热或与酸反应都可生成二氧化碳气体;
C.Mg (OH)2分解吸热降低温度,生成氧化镁,氧化镁熔点高;
D.铜与浓硝酸反应,常温下铝与浓硝酸发生钝化.
解答 解:A.在FeCl3饱和溶液中通入足量NH3可得到Fe(OH)3沉淀,得不到胶体,故A错误;
B.碳酸氢钠不稳定,加热或与酸反应都可生成二氧化碳气体,则可用于焙制糕点的膨松剂,但不是和碱反应的原因,故B错误;
C.Mg (OH)2分解吸热降低温度,生成氧化镁,氧化镁熔点高,可用作阻燃剂,故C正确;
D.铜与浓硝酸反应,常温下铝与浓硝酸发生钝化,所以不能用铜罐代替铝罐贮运浓硝酸,故D错误;
故选:C.
点评 本题考查了氢氧化铁胶体的制备、碳酸氢钠、氢氧化镁、氧化镁、浓硝酸的性质,题目难度不大,注意对基础知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 1mol Cl2在反应中得到电子数不一定为NA | |
| B. | 1mol O2在反应中得到电子数一定为4NA | |
| C. | 1molNa2O2与足量H2O反应,转移了NA个电子 | |
| D. | 在2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O中,氯气既是氧化产物又是还原产物 |
18.下列离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | 澄清石灰水与过量苏打溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 碘化亚铁中通入氯气:2I-+Cl2═I2+2Cl- |
15.下列四位同学设计的实验方案能达到实验目的是( )
| A. | 甲同学为测定0.01mol•L-1盐酸的pH值:用湿的玻璃棒蘸取盐酸,点在pH试纸上 | |
| B. | 乙同学要检验(NH4)2Fe(SO4)2•12H2O晶体中的NH4+:取少量晶体溶于水,加入足量浓NaOH溶液并加热,再用湿润的蓝色石蕊试纸检验产生的气体 | |
| C. | 丙同学为检验Fe3O4中+2价铁元素:先用稀盐酸溶解Fe3O4,再滴加KMnO4溶液 | |
| D. | 丁同学要验证FeCl3与KI反应的限度:可将少量的FeCl3溶液与过量的KI溶液混合,充分反应后用CCl4萃取,静置,再滴加KSCN溶液 |
2.如图所示的甲、乙两个装置中(常温),胶头滴管中吸入某种液体,圆底烧瓶中充入(或放入)另一种物质,挤压胶头滴管中液体,一段时间后两装置中的气球都有明显地胀大(忽略液体体积对气球的影响).则所用试剂分别可能依次是( )
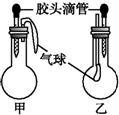 | 甲 | 乙 | |||
| 滴管中 | 烧瓶中 | 滴管中 | 烧瓶中 | ||
| A | 水 | 过氧化钠 | 饱和碳酸氢钠溶液 | CO2 | |
| B | NaOH溶液 | 铝 | 硫酸钠溶液 | CO2 | |
| C | NaOH溶液 | 碳酸氢钠 | 澄清石灰水 | 碳酸氢钠 | |
| D | 稀盐酸 | 碳酸氢钠 | NaOH溶液 | CO2 | |
| A. | A | B. | B | C. | C | D. | D |
19.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
回答下列问题:
(1)该电池的正极反应式为MnO2+e-+H+═MnOOH,电池反应的离子方程式为:Zn+2MnO2+2H+═Zn2++2MnOOH
(2)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的正极反应式为MnO2+e-+H+═MnOOH,电池反应的离子方程式为:Zn+2MnO2+2H+═Zn2++2MnOOH
(2)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
20.高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂.工业制高铁酸钠的方法有如下两种:湿法制备的主要离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,干法制备的主要反应方程式为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑.则下列有关说法不正确的是( )
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中FeO42-是氧化产物 | |
| C. | 干法中每生成1 molNa2FeO4转移4mol电子 | |
| D. | Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 |