题目内容
11.某原电池的总反应为:Cu+2Fe3+═Cu2++2Fe2+( )| A | B | C | D | |
| 电极材料 | Cu、Zn | Cu、Ag | Fe、Zn | Cu、C |
| 插入溶液 | FeCl3 | Fe(NO3) 2 | CuSO4 | Fe2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据电池反应式知,铜失电子发生氧化反应而作负极,不如铜活泼的金属或导电的非金属作正极,正极上铁离子得电子发生还原反应,所以电解质溶液为可溶性的铁盐,以此解答该题.
解答 解:根据Cu+2Fe3+═Cu2++2Fe2+知,铜失电子化合价升高而发生氧化反应,则铜作负极,不如铜活泼的金属或导电的非金属作正极,正极上铁离子得电子而发生还原反应,所以电解质溶液为可溶性的铁盐,如氯化铁、硫酸铁等,则符合条件的原电池为D,故选D.
点评 本题考查原电池知识,为高频考点,侧重于基本理论知识的综合理解和运用的考查,注意把握原电池组成和工作原理,难度不大.

练习册系列答案
相关题目
1.NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 1mol Cl2在反应中得到电子数不一定为NA | |
| B. | 1mol O2在反应中得到电子数一定为4NA | |
| C. | 1molNa2O2与足量H2O反应,转移了NA个电子 | |
| D. | 在2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O中,氯气既是氧化产物又是还原产物 |
2.如图所示的甲、乙两个装置中(常温),胶头滴管中吸入某种液体,圆底烧瓶中充入(或放入)另一种物质,挤压胶头滴管中液体,一段时间后两装置中的气球都有明显地胀大(忽略液体体积对气球的影响).则所用试剂分别可能依次是( )
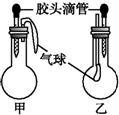 | 甲 | 乙 | |||
| 滴管中 | 烧瓶中 | 滴管中 | 烧瓶中 | ||
| A | 水 | 过氧化钠 | 饱和碳酸氢钠溶液 | CO2 | |
| B | NaOH溶液 | 铝 | 硫酸钠溶液 | CO2 | |
| C | NaOH溶液 | 碳酸氢钠 | 澄清石灰水 | 碳酸氢钠 | |
| D | 稀盐酸 | 碳酸氢钠 | NaOH溶液 | CO2 | |
| A. | A | B. | B | C. | C | D. | D |
19.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
回答下列问题:
(1)该电池的正极反应式为MnO2+e-+H+═MnOOH,电池反应的离子方程式为:Zn+2MnO2+2H+═Zn2++2MnOOH
(2)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的正极反应式为MnO2+e-+H+═MnOOH,电池反应的离子方程式为:Zn+2MnO2+2H+═Zn2++2MnOOH
(2)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
6.25℃时,某溶液中可能含以下几种离子:Na+、H+、Fe3+、HCO3-、OH-、I-.已知溶液中由水电离出的c(H+)=10-13mol•L-1,向该溶液中通入一定量的Cl2后,溶液由无色变为黄色,下列有关该溶液的说法中正确的是( )
| A. | 该溶液的pH一定等于1 | |
| B. | 阴离子肯定有I-,不能确定有无HCO3- | |
| C. | 阳离子肯定没有Fe3+,可能有Na+ | |
| D. | 该溶液含有的溶质成分可能为HI或HI和NaI或NaI和NaOH或NaI |
16.下列化学用语能够正确表示盐类水解的是(
| A. | HSO3-+H20?SO32-+H3O+ | B. | S2-+H2O?H2S+2OH- | ||
| C. | Cu2++4H2O?Cu(OH)2+2H3O+ | D. | NH3•H2O+H3O+?NH4++2H2O |
3.下列关于溶液和胶体的说法正确的是( )
| A. | 可以利用电泳现象区分溶液和胶体 | |
| B. | 可以利用胶体的丁达尔效应区分溶液和胶体 | |
| C. | 可以用过滤的方法分离溶液和胶体 | |
| D. | 溶液呈电中性,胶体是带电的 |
20.高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂.工业制高铁酸钠的方法有如下两种:湿法制备的主要离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,干法制备的主要反应方程式为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑.则下列有关说法不正确的是( )
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中FeO42-是氧化产物 | |
| C. | 干法中每生成1 molNa2FeO4转移4mol电子 | |
| D. | Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 |



