题目内容
9.氮化铝(AlN)是一种新型无机非金属材料,其制取原理为:Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.在制取氮化铝时由于反应不完全,产品中有氧化铝和碳.为了分析某AlN样品的组成,某实验小组进行了如下探究.【实验1】测定样品中氮元素的质量分数.
取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).

已知:AlN+NaOH+H2O═NaAlO2+NH3↑
(1)如图C装置中球形干燥管的作用是防倒吸.
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性,再加入实验药品.然后关闭K1,打开K2,
打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,缓缓通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是把装置中残留的氨气全部赶入C装置.
(3)若去掉装置B,则导致测定结果偏高偏高
(填“偏高”、“偏低”或“无影响”).由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见C装置出口处连接一个干燥装置.
【实验2】按以下步骤测定样品中铝元素的质量分数.
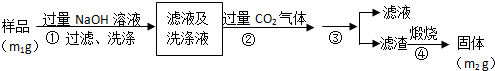
(4)步骤②生成沉淀的离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓.
(5)操作③需要的玻璃仪器有漏斗、玻璃棒和烧杯.
(6)过滤、洗涤
(7)Al元素的质量分数为$\frac{9m{\;}_{2}}{17m{\;}_{1}}$(用m1、m2表示).
分析 [实验1]
测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的质量来计算氮化铝的含量,则A中发生的反应为A1N+NaOH+H2O=NaAlO2+NH3↑,生成的氨气被碱石灰干燥,然后将氨气通入稀硫酸中被硫酸吸收生成硫酸铵,通入的氮气能将生成的氨气完全排出;
(1)氨气极易溶于水和稀硫酸,缓冲装置能防止倒吸;
(2)有连接的装置在使用前必须检查装置气密性;然后加入药品,将关闭K1,打开K2同时打开分液漏斗的活塞;通入的氮气能把装置中残留的氨气全部赶入C装置;
(3)浓硫酸具有吸水性,能吸收氨气中的水蒸气;浓硫酸能吸收空气中的水蒸气;
[实验2]
测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的体积来计算氮化铝的含量,样品溶液过量NaOH溶液,发生反应A1N+NaOH+H2O=NaAlO2+NH3↑,向滤液中通入过量二氧化碳,发生的反应为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,然后过滤,得到的滤渣为Al(OH)3,煅烧滤渣,发生反应2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
(4)偏铝酸钠和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠;
(5)过滤时需要的玻璃仪器有漏斗、玻璃棒及烧杯;
(7)根据Al原子守恒计算;
解答 解:[实验1]
测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的质量来计算氮化铝的含量,则A中发生的反应为A1N+NaOH+H2O=NaAlO2+NH3↑,生成的氨气被碱石灰干燥,然后将氨气通入稀硫酸中被硫酸吸收生成硫酸铵,通入的氮气能将生成的氨气完全排出;
(1)氨气极易溶于水和稀硫酸,缓冲装置能防止倒吸,导致的干燥管有缓冲作用,所以能防止倒吸,
故答案为:防倒吸;
(2)有连接的装置在使用前必须检查装置气密性,所以该实验之前必须检验装置气密性;然后加入药品,将关闭K1,打开K2同时打开分液漏斗的活塞,从而发生A中的反应;通入的氮气能把装置中残留的氨气全部赶入C装置,否则易导致测定结果偏小,
故答案为:检查装置气密性;关闭K1,打开K2;把装置中残留的氨气全部赶入C装置;
(3)浓硫酸具有吸水性,能吸收氨气中的水蒸气,如果去掉装置B,则氨气中的水蒸气被浓硫酸吸收而导致测定结果偏大;C装置直接连接空气,浓硫酸能吸收空气中的水蒸气而导致测定结果偏高,其改进措施为C装置出口处连接一个干燥装置,
故答案为:偏高;C装置出口处连接一个干燥装置;
[实验2]
测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的体积来计算氮化铝的含量,样品溶液过量NaOH溶液,发生反应A1N+NaOH+H2O=NaAlO2+NH3↑,向滤液中通入过量二氧化碳,发生的反应为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,然后过滤,得到的滤渣为Al(OH)3,煅烧滤渣,发生反应 2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
(4)偏铝酸钠和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(5)过滤时需要的玻璃仪器有漏斗、玻璃棒及烧杯,
故答案为:漏斗、玻璃棒和烧杯;
(7)根据Al原子守恒得n(Al)=2n[Al2O3],所以m(Al)=$\frac{m{\;}_{2}g}{102g/mol}$=$\frac{27m{\;}_{2}}{51}$g,则Al元素质量分数=$\frac{\frac{27m{\;}_{2}}{51}g}{{m}_{1}g}$×100%=$\frac{9m{\;}_{2}}{17m{\;}_{1}}$,
故答案为:$\frac{9m{\;}_{2}}{17m{\;}_{1}}$.
点评 本题考查物质制备、物质含量测定等知识点,为高频考点,涉及质量分数计算、基本实验操作、尾气处理、误差分析等知识点,明确实验原理、实验基本操作等知识点即可解答,难点是实验误差分析,题目难度中等.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的正极反应式为MnO2+e-+H+═MnOOH,电池反应的离子方程式为:Zn+2MnO2+2H+═Zn2++2MnOOH
(2)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中FeO42-是氧化产物 | |
| C. | 干法中每生成1 molNa2FeO4转移4mol电子 | |
| D. | Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 |
| A. | 原电池中负极发生还原反应 | |
| B. | 可充电电池充电时负极连接外加电源的负极 | |
| C. | 铁制品上电镀铜时铜作阴极 | |
| D. | 原电池工作时盐桥中阳离子流向负极 |
| A. | 16g CH4中含有4NA个C-H键 | |
| B. | 一定条件下,氨与氧气在催化剂作用下反应生成30g NO,转移电子数为5NA个 | |
| C. | 常温常压下,13.8g NO2与水充分反应,产生0.1N A个NO分子 | |
| D. | 标准状况下,22.4 LCCl4中含有N A个CCl4分子 |
 $→_{△}^{-H_{20}}$CH3CH=CHCHO,水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
$→_{△}^{-H_{20}}$CH3CH=CHCHO,水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:

 Cu2O在稀硫酸中生成Cu和CuSO4,铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为12.
Cu2O在稀硫酸中生成Cu和CuSO4,铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为12. 实验室可用如图所示装置(缺少收集装置,夹持固定装置以略去)制备并收集氨.
实验室可用如图所示装置(缺少收集装置,夹持固定装置以略去)制备并收集氨.