题目内容
Ⅰ在催化剂作用下,CO2和H2可以制取甲醇.用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:

写出由二氧化碳和氢气制备甲醇的热化学方程式: .
Ⅱ硼氢化钠(NaBH4)是有机合成中的重要还原剂.最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:
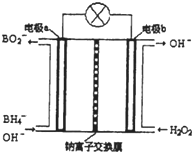
(1)电极b为 (填“正极”或“负极”),电极a上发生反应的电极反应式为 .
(2)电池工作时,Na+向 极(填“a”或“b”)移动,当左槽产生0.0125mol BO2-离子时,右槽溶液pH=
(3)用该电池电解一定浓度的CuSO4溶液至无色后继续电解一段时间.断开电路,向溶液中加入0.1mol Cu(OH)2,溶液恢复到电解之前状态,则电解过程中转移电子数目为 .
| ||

写出由二氧化碳和氢气制备甲醇的热化学方程式:
Ⅱ硼氢化钠(NaBH4)是有机合成中的重要还原剂.最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:

(1)电极b为
(2)电池工作时,Na+向
(3)用该电池电解一定浓度的CuSO4溶液至无色后继续电解一段时间.断开电路,向溶液中加入0.1mol Cu(OH)2,溶液恢复到电解之前状态,则电解过程中转移电子数目为
考点:化学电源新型电池,热化学方程式,电解原理
专题:化学反应中的能量变化,电化学专题
分析:Ⅰ、分析图象书写热化学方程式,结合盖斯定律计算得到;
Ⅱ、以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,结合原电池的工作原理和电子守恒以及pH的计算来解答,若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度,则电解硫酸铜之后发生水的电解,以此来解答.
Ⅱ、以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,结合原电池的工作原理和电子守恒以及pH的计算来解答,若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度,则电解硫酸铜之后发生水的电解,以此来解答.
解答:
解:Ⅰ、图象分析书写热化学方程式为:①CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41KJ/mol,②CO(g)+2H2(g)=CH3OH(l)△H=-91KJ/mol;依据盖斯定律②-①得到:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol,
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
Ⅱ.(1)根据图示内容,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故答案为:正;BH4-+8OH--8e-=BO2-+6H2O;
(2)原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,根据电极反应:BH4-+8OH--8e-=BO2-+6H2O,当左槽产生0.0125mol BO2-离子时,转移电子是0.1mol,此时根据正极上电极反应H2O2+2e-=2OH-,则生成氢氧根离子的物质的量是0.1mol,则氢氧根离子浓度是0.1mol/L,所以pH=13,
故答案为:b;13;
(3)乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度,发生2CuSO4+2H2O
2Cu+O2↑+2H2SO4、2H2O
2H2↑+O2↑,由Cu(OH)2
CuO+H2O,则转移的电子数为(0.1mol×2+0.1mol×2)×NA=0.4NA,故答案为:0.4NA.
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
Ⅱ.(1)根据图示内容,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故答案为:正;BH4-+8OH--8e-=BO2-+6H2O;
(2)原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,根据电极反应:BH4-+8OH--8e-=BO2-+6H2O,当左槽产生0.0125mol BO2-离子时,转移电子是0.1mol,此时根据正极上电极反应H2O2+2e-=2OH-,则生成氢氧根离子的物质的量是0.1mol,则氢氧根离子浓度是0.1mol/L,所以pH=13,
故答案为:b;13;
(3)乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度,发生2CuSO4+2H2O
| ||
| ||
| ||
点评:本题考查电化学盖斯定律的计算、原电池工作原理,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.

练习册系列答案
相关题目
W、X、Y、Z 均为短周期主族元素,Y的原子序数是W和Z 的原子序数之和的一半,Y原子的最外层电子数与核外电子总数之比为2:7;W和Z形成的可溶性化合物WZ溶于水中不能促进水的电离;W、X、Z三种元素形成的某种化合物能消毒杀菌.下列说法正确的是( )
| A、四种元素原子中,原子半径最大的是Z |
| B、X、Y形成的化合物能溶于盐酸 |
| C、Z的最高价氧化物对应水化物的酸性强于Y的 |
| D、1mol W单质与足量X单质反应,转移的电子数为2NA |
常温下,浓度均为0.1mol/L的4种溶液pH如下表:
下列说法正确的是( )
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 4.0 |
| A、0.1 mol/L Na2CO3溶液加水,稀释后溶液中所有离子的浓度均减少 |
| B、NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| C、NaHSO3溶液中:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)>c(H+)>c(OH-) |
| D、向NaClO溶液中滴加硫酸至中性时,2c(SO42-)=c(HClO) |
下列图示与对应叙述相符合的是( )


| A、图Ⅰ所示锌锰碱性电池正极的电极反应式为:MnO2+H2O+2e-═MnOOH+OH- |
| B、图Ⅱ表示盐酸滴加到0.1 mol?L-1某碱溶液中得到的滴定曲线,由图Ⅱ可知二者恰好中和时,所得溶液的pH>7 |
| C、图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液时,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时,沉淀全部是BaSO4 |
| D、图Ⅳ表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
