题目内容
Ⅰ.已知下列反应的热化学方程式为:
(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol
请计算:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H4= .
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2?2(t-BuNO).该温度下该反应在CCl4溶剂中的平衡常数为1.4.
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1L).反应在前10min内的平均速率为ν(t-BuNO)= .列式计算上述反应的平衡常数K= .
(2)有关反应:(t-BuNO)2?2(t-BuNO)的叙述正确的是
A.压强越大,反应物的转化率越大
B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线.

Ⅲ.甲醇燃料电池的电解质溶液是KOH溶液.则通甲醇的电极反应式为 .若通空气的电极上有32g O2参加反应,则反应过程中转移了 mol e-.
(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol
请计算:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H4=
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2?2(t-BuNO).该温度下该反应在CCl4溶剂中的平衡常数为1.4.
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1L).反应在前10min内的平均速率为ν(t-BuNO)=
(2)有关反应:(t-BuNO)2?2(t-BuNO)的叙述正确的是
A.压强越大,反应物的转化率越大
B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线.

| 时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
| c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
| c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.07 | 0.094 | 0.096 | 0.096 |
考点:用盖斯定律进行有关反应热的计算,常见化学电源的种类及其工作原理,化学平衡常数的含义,化学平衡的计算
专题:化学平衡专题,电化学专题
分析:Ⅰ、利用盖斯定律解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得.
Ⅱ、(1)用三段式法,求出△c可得v(t-BuNO);K也需三段式法求解.
(2)注意物质的状态,利用题给在CCl4中的K值和求得在正庚烷中的K值比较即可.
(3)画图时注意起点、拐点和终点,9min时反应达到平衡状态.
Ⅲ、燃料电池电极反应式书写,注意电解质溶液可以与CO2反应;1mol氧气反应转移4mol电子.
Ⅱ、(1)用三段式法,求出△c可得v(t-BuNO);K也需三段式法求解.
(2)注意物质的状态,利用题给在CCl4中的K值和求得在正庚烷中的K值比较即可.
(3)画图时注意起点、拐点和终点,9min时反应达到平衡状态.
Ⅲ、燃料电池电极反应式书写,注意电解质溶液可以与CO2反应;1mol氧气反应转移4mol电子.
解答:
解:Ⅰ、已知
(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol
据盖斯定律,(1)×2-(2)+(3)得:
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H4=(-393.5kJ/mol)×2-(-870.3kJ/mol)+(-571.6kJ/mol)=-488.3kJ/mol
故答案为:-488.3kJ/mol;
Ⅱ(1)△n(t-BuNO)=0.50mol×60%×2=0.6mol,v(t-BuNO)=
=
=0.06mol?L-1?min-1
当(t-BuNO)2的起始浓度(c0)为0.50mol?L-1时,实验测得平衡转化率(α)是60%,
则 (t-BuNO)2 2(t-BuNO)
2(t-BuNO)
开始浓度(mol?L-1) 0.5 0
转化浓度(mol?L-1) 0.5×60% 0.5×60%×2
平衡浓度(mol?L-1) 0.5×(1-60%) 0.5×60%×2
K=
=
=1.8mol/L
故答案为:0.06mol?L-1?min-1;1.8mol/L
(2)A、因为该反应在溶液中进行,无气体参与反应,所以压强的变化对平衡移动无影响,故A错误;
B、不知道该反应是放热还是吸热,故B错误;
C、在CCl4溶剂中的平衡常数为1.4,在正庚烷中的K值为1.8,故C正确.
故选C;
(3)从表中数据可见,t-BuNO的浓度从0开始,9min时达到平衡,浓度变为0.096mol/L,(t-BuNO)2的浓度从0.05mol/L开始,9min时变为0.002mol/L达到平衡,平衡后,各自的浓度不再变化,如图所示: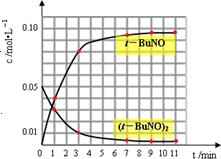 ,
,
故答案为: ;
;
Ⅲ、甲醇燃料电池在碱性环境中的总反应方程式为2CH4O+3O2+4OH-→2CO32-+6H2O
碱性环境中,正极的电极反应式为O2+4e-+2H2O═4OH-
则负极的电极反应式=总反应式-正极反应式,
CH3OH+8OH--6 e-=CO32-+6H2O
从正极反应式O2+4e-+2H2O═4OH-可见,每有1mol氧气反应转移4mol电子,
故答案为:CH3OH+8OH--6 e-=CO32-+6H2O;4.
(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol
据盖斯定律,(1)×2-(2)+(3)得:
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H4=(-393.5kJ/mol)×2-(-870.3kJ/mol)+(-571.6kJ/mol)=-488.3kJ/mol
故答案为:-488.3kJ/mol;
Ⅱ(1)△n(t-BuNO)=0.50mol×60%×2=0.6mol,v(t-BuNO)=
| ||
| △t |
| ||
| 10min |
当(t-BuNO)2的起始浓度(c0)为0.50mol?L-1时,实验测得平衡转化率(α)是60%,
则 (t-BuNO)2
 2(t-BuNO)
2(t-BuNO)开始浓度(mol?L-1) 0.5 0
转化浓度(mol?L-1) 0.5×60% 0.5×60%×2
平衡浓度(mol?L-1) 0.5×(1-60%) 0.5×60%×2
K=
| c2(t-BuNO) |
| c(t-BuNO) |
| (0.6mol/L)2 |
| 0.2mol/L |
故答案为:0.06mol?L-1?min-1;1.8mol/L
(2)A、因为该反应在溶液中进行,无气体参与反应,所以压强的变化对平衡移动无影响,故A错误;
B、不知道该反应是放热还是吸热,故B错误;
C、在CCl4溶剂中的平衡常数为1.4,在正庚烷中的K值为1.8,故C正确.
故选C;
(3)从表中数据可见,t-BuNO的浓度从0开始,9min时达到平衡,浓度变为0.096mol/L,(t-BuNO)2的浓度从0.05mol/L开始,9min时变为0.002mol/L达到平衡,平衡后,各自的浓度不再变化,如图所示:
 ,
,故答案为:
 ;
;Ⅲ、甲醇燃料电池在碱性环境中的总反应方程式为2CH4O+3O2+4OH-→2CO32-+6H2O
碱性环境中,正极的电极反应式为O2+4e-+2H2O═4OH-
则负极的电极反应式=总反应式-正极反应式,
CH3OH+8OH--6 e-=CO32-+6H2O
从正极反应式O2+4e-+2H2O═4OH-可见,每有1mol氧气反应转移4mol电子,
故答案为:CH3OH+8OH--6 e-=CO32-+6H2O;4.
点评:本题考查全面,题目跨度大,有一定的难度,适合高三后期复习使用.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
下列叙述中正确的是( )
| A、铜-锌-稀硫酸组成的原电池中,锌为正极 |
| B、铜-锌-稀硫酸组成的原电池中,电解质溶液的质量逐渐减轻 |
| C、用石墨电极电解CuCl2溶液时,阳极上Cu2+放电而析出金属铜 |
| D、用石墨电极电解CuCl2溶液时,电解质溶液的浓度逐渐减小 |
化学在生产、生活中有着广泛的应用.下列说法正确的是( )
| A、农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 |
| B、厨房中燃气泄漏,立即打开抽油烟机排气 |
| C、硝酸是重要的工业原料,可用于制造炸药 |
| D、高纯硅可用于制作光导纤维,光导纤维遇强碱会“断路” |
实验:①0.1mol?L-1 MgCl2溶液和0.2mol?L-1 NaOH溶液等体积混合得到浊液a,取少量浊液a过滤得到滤液b和白色沉淀c;②向浊液a中滴加0.1mol?L-1 FeCl3溶液,出现红褐色沉淀.下列分析不正确的是( )
| A、滤液b的pH=7 |
| B、②中颜色变化说明Mg(OH)2转化为Fe(OH)3 |
| C、实验可以证明Fe(OH)3的溶解度比Mg(OH)2的小 |
| D、浊液a中存在沉淀溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq) |
 W、X、Y、Z、R为前四周期元素且原子序数依次增大.W与Y形成常温下呈液态的化合物G,X可以spm(m=1,2,3)杂化方式与X形成一系列X的化合物,X的单质在高温条件下与G反应生成W单质和气态化合物;W的单质与Z的单质在点燃或光照时均能反应生成1:1的水溶液为常见的酸;R原子的价电子层的未成对电子数为4.回答下列问题:
W、X、Y、Z、R为前四周期元素且原子序数依次增大.W与Y形成常温下呈液态的化合物G,X可以spm(m=1,2,3)杂化方式与X形成一系列X的化合物,X的单质在高温条件下与G反应生成W单质和气态化合物;W的单质与Z的单质在点燃或光照时均能反应生成1:1的水溶液为常见的酸;R原子的价电子层的未成对电子数为4.回答下列问题: