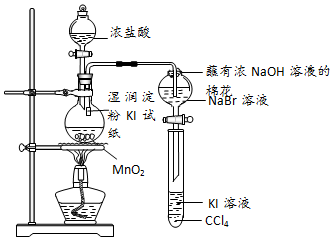
题目内容
7.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )| A. | 溶液中Ca2+数目减少 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值不变 | D. | 溶液pH值增大 |
分析 向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,消耗水,溶液c(Ca2+)、c(OH-)增大,由于原溶液已达到饱和,则平衡向逆反应方向移动,以此解答该题.
解答 解:向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,
A.加入CaO,消耗水,由于原溶液已达到饱和,则平衡向逆反应方向移动,溶液中Ca2+数目减少,故A正确;
B.反应后仍为饱和溶液,c(Ca2+)不变,故B错误;
C.反应后仍为饱和溶液,c(OH-)不变,溶液pH不变,故C正确;
D.反应后仍为饱和溶液,c(OH-)不变,溶液pH不变,故D错误.
故选AC.
点评 本题考查难溶电解质的溶解平衡,为高频考点,题目难度中等,本题注意向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,从平衡移动的角度分析.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
17.工业制硝酸过程中的一个重要反应为4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.下列有关该反应的说法不正确的是( )
| A. | O2是氧化剂 | B. | NH3是氧化剂 | C. | O2被还原 | D. | NH3发生氧化反应 |
15. 在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
a.此平衡体系,升温平衡向右移动.( A.向左、B.向右、C.不)
b.对原平衡,在t0时升高温度对化学反应速率产生影响,在图中绘出速率变化图.
 在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
b.对原平衡,在t0时升高温度对化学反应速率产生影响,在图中绘出速率变化图.
5.利用所学化学知识回答问题
Ⅰ、甲醇是重要的化工原料,又可称为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H=?
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-58kJ/mol
③CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
则x=413kJ/mol.
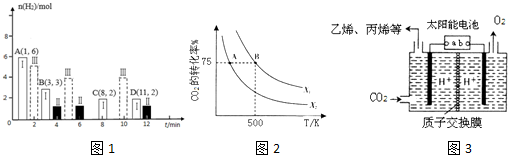
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图1中状态Ⅰ(图1中实线)所示.图1中数据A(1,6)代表在1min时H2的物质的量是6mol.
①T℃时,状态Ⅰ条件下,平衡常数K=0.5;
②其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度>(填“>”“<”或“=”)T℃;
③一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是bc.
a. 2个C=O断裂的同时有2个H-O生成 b.容器中混合气体平均摩尔质量不变
c.v逆(H2)=3v正(CH3OH) d.甲醇和水蒸气的体积比保持不变
Ⅱ、二氧化碳的回收利用是环保领域研究的热点课题.
(1)CO2经过催化氢化合成低碳烯烃.在2L恒容密闭容器中充入2moI CO2和nmol H2,在一定条件下发生反应:2C02(g)+6H2(g)?CH2=CH2(g)+4H20(g),△H=-128kJ/mol.CO2的转化率与温度、投料比[X=$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图2所示.
①X2> X1(填“>”、“<”或“=”)
②在500K时,若B点的投料比为3.5,且从反应开始到B点需要10min,则v(H2)=0.225mol/(L.min).
(2)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图3如下,则左侧产生乙烯的电极反应式为2CO2+12e-+12H+=CH2=CH2+4H2O.

Ⅰ、甲醇是重要的化工原料,又可称为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H=?
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-58kJ/mol
③CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C $\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | x |
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图1中状态Ⅰ(图1中实线)所示.图1中数据A(1,6)代表在1min时H2的物质的量是6mol.
①T℃时,状态Ⅰ条件下,平衡常数K=0.5;
②其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度>(填“>”“<”或“=”)T℃;
③一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是bc.
a. 2个C=O断裂的同时有2个H-O生成 b.容器中混合气体平均摩尔质量不变
c.v逆(H2)=3v正(CH3OH) d.甲醇和水蒸气的体积比保持不变
Ⅱ、二氧化碳的回收利用是环保领域研究的热点课题.
(1)CO2经过催化氢化合成低碳烯烃.在2L恒容密闭容器中充入2moI CO2和nmol H2,在一定条件下发生反应:2C02(g)+6H2(g)?CH2=CH2(g)+4H20(g),△H=-128kJ/mol.CO2的转化率与温度、投料比[X=$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图2所示.
①X2> X1(填“>”、“<”或“=”)
②在500K时,若B点的投料比为3.5,且从反应开始到B点需要10min,则v(H2)=0.225mol/(L.min).
(2)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图3如下,则左侧产生乙烯的电极反应式为2CO2+12e-+12H+=CH2=CH2+4H2O.
9.已知常温常压下,P2和P4燃烧的热化学方程式分别为:
2P2(g)+5O2(g)═P4O10(s)△H=-2 695.4kJ•mol-1,
P4(g)+5O2(g)═P4O10(s)△H=-2 925.1kJ•mol-1.则下列说法正确的是( )
2P2(g)+5O2(g)═P4O10(s)△H=-2 695.4kJ•mol-1,
P4(g)+5O2(g)═P4O10(s)△H=-2 925.1kJ•mol-1.则下列说法正确的是( )
| A. | 2P2(g)═P4(g)△H=-229.7 kJ•mol-1 | B. | P2制P4是放热反应 | ||
| C. | P2比P4更加稳定 | D. | 等质量时,P2比P4具有的能量高 |