题目内容
用相应的离子方程式说明原因:
(1)配制氯化铁溶液时,往往需要加入少量的稀盐酸: .
(2)热的纯碱溶液可以用来除油污: .
(3)泡沫灭火器中装的是NaHCO3和Al2(SO4)3两种浓溶液,可用来灭火: .
(1)配制氯化铁溶液时,往往需要加入少量的稀盐酸:
(2)热的纯碱溶液可以用来除油污:
(3)泡沫灭火器中装的是NaHCO3和Al2(SO4)3两种浓溶液,可用来灭火:
考点:离子方程式的书写
专题:离子反应专题
分析:(1)铁离子水解,加盐酸可抑制水解,且不引入新杂质;
(2)纯碱水解显碱性,可促进油污的水解,而热的纯碱水解程度增大;
(3)NaHCO3和Al2(SO4)3两种浓溶液,相互促进水解生成大量二氧化碳气体.
(2)纯碱水解显碱性,可促进油污的水解,而热的纯碱水解程度增大;
(3)NaHCO3和Al2(SO4)3两种浓溶液,相互促进水解生成大量二氧化碳气体.
解答:
解:(1)FeCl3为强酸弱碱盐,Fe3+离子水解使溶液呈酸性,水解离子方程式为Fe3++3H2O?Fe(OH)3+3H+,故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(2)纯碱水解显碱性,可促进油污的水解,而热的纯碱水解程度增大,水解离子反应为反应的离子方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-;
(3)NaHCO3和Al2(SO4)3两种浓溶液,相互促进水解生成大量二氧化碳气体,水解离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(2)纯碱水解显碱性,可促进油污的水解,而热的纯碱水解程度增大,水解离子反应为反应的离子方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-;
(3)NaHCO3和Al2(SO4)3两种浓溶液,相互促进水解生成大量二氧化碳气体,水解离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评:本题考查离子反应方程式的书写,为高频考点,把握水解原理及应用为解答的关键,侧重水解离子反应的书写及分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组离子在指定溶液中一定能大量共存的是( )
| A、无色溶液中:K+、Cu2+、Na+、SO42- |
| B、强酸性溶液中:Al3+、NO3-、I-、Cl- |
| C、pH=11的溶液中:Na+、CO32-、AlO2-、NO3- |
| D、加入Al能放出H2的溶液中:NH4+、Cl-、HCO3-、NO3- |
下列排列顺序正确的是( )
| A、常温下水电离出的c(H+):pH=5的CH3COOH溶液>pH=5的盐酸 |
| B、微粒半径:Fe(OH)3胶粒>K+>C1->Na+ |
| C、等温等物质的量浓度溶液的pH:Na2CO3>苯酚钠>NaHCO3 |
| D、氢化物的沸点:H2Se>H2S>H2O |
下列组合中在任何温度下反应均能自发进行的是( )
| A、△H>0,△S>0 |
| B、△H<0,△S<0 |
| C、△H>0,△S<0 |
| D、△H<0,△S>0 |
将2gNaOH固体溶于水配成250mL溶液,溶液中NaOH的物质的量浓度为( )
| A、0.04mol/L |
| B、0.2mol/L |
| C、1mol/L |
| D、2m01/L |
设NA为阿伏加德罗常数的数值,则下列说法中正确的是( )
| A、2.4g金属镁所含电子数目为0.2NA |
| B、1摩尔CH4所含质子数目为10NA |
| C、标准状况下22.4LH2O所含分子数目为NA |
| D、18gNH4+所含电子数目为10 NA |
下列物质的化学用语正确的是( )
①NH4H的电子式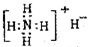
②硝基苯的结构简式:
③葡萄糖的实验式:CH2O
④甲烷分子的比例模型: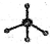
⑤Fe2+的离子结构:
⑥原子核内有10个中子的氧原子:
O.
①NH4H的电子式
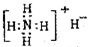
②硝基苯的结构简式:

③葡萄糖的实验式:CH2O
④甲烷分子的比例模型:

⑤Fe2+的离子结构:

⑥原子核内有10个中子的氧原子:
18 8 |
| A、②③⑥ | B、①③⑤⑥ |
| C、③⑥ | D、①②③④⑤⑥ |
