题目内容
17.造成大气污染的SO2主要来源于( )| A. | 火山喷发 | |
| B. | 自然界中游离态硫缓慢氧化 | |
| C. | 煤、石油等含硫燃料的大量燃烧、硫矿石的冶炼及硫酸工业等产生的工业废气 | |
| D. | 汽车尾气 |
分析 我国的能源以化石能源为主,化石能源燃烧排放出大量的二氧化硫,且工业废气含较多的二氧化硫,以此来解答.
解答 解:煤、石油等含硫燃料的大量燃烧、硫矿石的冶炼及硫酸工业等产生的工业废气为造成大气污染的SO2主要来源,但火山爆发中的SO2、S的缓慢氧化,汽车尾气均非空气中SO2污染的主要来源,
故选C.
点评 本题考查三废处理及环境保护,为高频考点,把握二氧化硫对环境的影响、二氧化硫的来源为解答的关键,侧重分析与应用能力的考查,注意结合我国能源结构分析,题目难度不大.

练习册系列答案
相关题目
8.“环境保护”意识深入人心,下列关于酸雨的认识中错误的是( )
| A. | .正常条件下,pH值小于5.6的降雨是“酸雨” | |
| B. | 冰岛火山喷发含有大量SO2,在局部区域形成酸雨 | |
| C. | 全球“低碳”行动能减少CO2排放量,也就能降低酸雨的形成及危害 | |
| D. | 汽车尾气含有氮氧化合物,过量排放形成酸雨 |
12.温度700℃时,向容积为1L的密闭容器中充入一定量的CO和H2O发生反应CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t1<t2).下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 0.60 | 0.30 |
| t1 | 0.40 | |
| t2 | 0.10 |
| A. | 反应在t1min内的平均速率为v(H2)=0.20/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.10molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| C. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| D. | 700℃时,若向密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为0.60mol、1.00mol、0.60mol、0.60mol,则此时该反应v(正)<v(逆) |
6.下列化合物中,属于酸性氧化物的是( )
| A. | MgO | B. | SO2 | C. | H2SO4 | D. | CO |
7.下列反应的离子方程式正确的是( )
| A. | 铜跟稀HNO3反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| B. | 向硫酸铝溶液中加入过量氨水:Al3++3OH-═AlO2-+2H2O | |
| C. | 向Ag(NH3)2NO3溶液中加入盐酸:Ag(NH3)2+2H+═Ag++2NH4+ | |
| D. | NaHSO4溶液和Ba(OH)2溶液混合后溶液呈中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
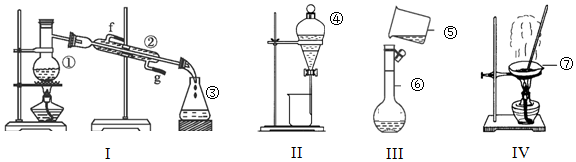
 .(不考虑空间构型)
.(不考虑空间构型)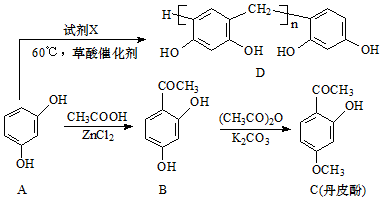
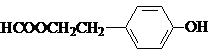 (写结构简式).
(写结构简式).