题目内容
6.下列化合物中,属于酸性氧化物的是( )| A. | MgO | B. | SO2 | C. | H2SO4 | D. | CO |
分析 氧化物只有两种元素,且必须有氧元素,酸性氧化物是与碱反应生成盐和水的氧化物,中心原子化合价不变,溶于水一般生成酸的氧化物.
解答 解:A.MgO是氧化物,能与酸反应生成盐和水,属于碱性氧化物,故A错误;
B.SO2与碱反应生成盐和水,属于酸性氧化物,故B正确;
C.H2SO4含有三种元素,不是氧化物,属于酸,故C错误;
D.CO虽然是氧化物,但与碱不发生反应,不是酸性氧化物,故D错误;
故选B.
点评 本题主要考查氧化物的概念,解答时要分析物质的元素组成,然后再根据氧化物概念的含义进行分析、判断,从而得出正确的结论,题目难度不大.

练习册系列答案
相关题目
16.已知常温下向AgCl饱和溶液中滴加一定浓度的KI溶液,可观察到白色沉淀逐渐变成黄色.由此可知下列有关说法正确的是( )
| A. | 相同温度下,Ksp(AgI)>Ksp(AgCl) | |
| B. | 由于AgCl与AgI的饱和水溶液几乎都不导电说明这两种物质均为非电解质 | |
| C. | 分别用等体积的蒸馏水和0.01 mol/L KI溶液洗涤AgI沉淀,用水洗涤沉淀损失量大 | |
| D. | 将AgCl与AgI的饱和溶液等体积混合后,再加入足量浓AgNO3溶液,只有AgI沉淀生成 |
17.造成大气污染的SO2主要来源于( )
| A. | 火山喷发 | |
| B. | 自然界中游离态硫缓慢氧化 | |
| C. | 煤、石油等含硫燃料的大量燃烧、硫矿石的冶炼及硫酸工业等产生的工业废气 | |
| D. | 汽车尾气 |
14.下列实验操作能达到实验目的是( )
| 实验操作 | 实验目的 | |
| A | 将SO2通入紫色石蕊溶液中 | 证明SO2具有漂白性 |
| B | 取两支试管,分别加入4mlL0.01mol•L-1KMnO4溶液,然后向另一支试管中加入0.1mol•L-1H2C2O4溶液2mL,向另一支试管中加入0.1mol•L-1H2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大,反应速率越快 |
| C | 向10mL0.2mol•L-1NaOH溶液中滴入2滴0.1mol•L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的溶度积: Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向含酚酞的Na2SO3溶液中加入BaCl2溶液 | 证明Na2SO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
1.下列说法中,正确的是( )
| A. | 液氯和氯水都含有氯离子 | |
| B. | 氯气和液氯都能使干燥的有色布条褪色 | |
| C. | 盐酸和氯水都含有氯离子 | |
| D. | 盐酸和氯水都能使湿润的有色布条褪色 |
11.下列说法正确的是( )
| A. | 化合物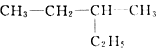 的名称是2-乙基丁烷 的名称是2-乙基丁烷 | |
| B. | 2-甲基丁烷和2,2-二甲基丙烷互为同系物 | |
| C. | 常温下,乙烯和苯都能被酸性KMnO4氧化,使KMnO4溶液褪色 | |
| D. | 等物质的量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等 |
18.下列仪器名称为“烧杯”的是( )
| A. | 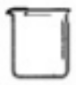 | B. |  | C. | 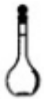 | D. | 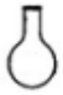 |
15.诺氟沙星别名氟哌酸,是治疗肠炎痢疾的常用药.其结构简式如图,下列说法正确的是( )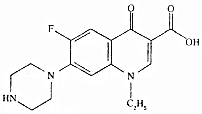

| A. | 该化合物属于苯的同系物 | |
| B. | 分子式为Cl6 H16FN3O3 | |
| C. | 1mol该化合物中含有6NA个双键 | |
| D. | 该化合物能与酸性高锰酸钾、溴水、碳酸氢钠溶液反应 |
3.下列离子方程式书写完全正确的是( )
| A. | 用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合至溶液显中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 在碳酸氢镁溶液中加入过量氢氧化钠溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2H2O+2CO32- | |
| D. | 向稀醋酸中加入石灰石:CaCO3+2H+=Ca2++CO2↑+H2O |