题目内容
12.温度700℃时,向容积为1L的密闭容器中充入一定量的CO和H2O发生反应CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t1<t2).下列说法正确的是( )| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 0.60 | 0.30 |
| t1 | 0.40 | |
| t2 | 0.10 |
| A. | 反应在t1min内的平均速率为v(H2)=0.20/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.10molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| C. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| D. | 700℃时,若向密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为0.60mol、1.00mol、0.60mol、0.60mol,则此时该反应v(正)<v(逆) |
分析 A.根据v=$\frac{△c}{△t}$计算v(CO),结合化学反应速率之比等于化学计量数之比计算v(H2);
B.保持其他条件不变,增加一种反应物的浓度,平衡向正反应方向移动,另一种反应物的转化率增大;
C.根据平衡时各物质的浓度计算700℃时的平衡常数,比较不同温度下的平衡常数大小可判断反应的吸放热;
D.计算生成物与反应物的浓度幂之积,与平衡常数相比较,可判断反应的方向.
解答 解:A.由表中数据可知v(CO)=$\frac{\frac{0.60mol-0.40mol}{1L}}{{t}_{1}}$=$\frac{0.20}{{t}_{1}}$mol•L-1•min-1,化学反应速率之比等于化学计量数之比,则v(H2)=v(CO)=$\frac{0.20}{{t}_{1}}$mol•L-1•min-1,故A正确;
B.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故B错误;
C.在t1min n(CO)=0.40mol,消耗0.20molCO,则消耗0.20mol氢气,此时氢气的物质的量为0.10mol,而t2时不变,说明t1min已达到平衡状态,t1min时反应已经达到平衡状态,此时c(CO)=$\frac{0.4mol}{1L}$=0.4mol/L,c(H2O)=$\frac{0.1mol}{1L}$=0.1mol/L,c(CO2)=c(H2)=$\frac{0.2mol}{1L}$=0.2mol/L,则k=$\frac{0.2×0.2}{0.4×0.1}$=1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应,故C错误;
D.700℃时,若向密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为0.60mol、1.00mol、0.60mol、0.60mol,则$\frac{0.60×0.60}{0.60×1.00}$=0.6<1,说明没有达到平衡,平衡正向移动,则v(正)>v(逆),故D错误.
故选A.
点评 本题属于化学平衡计算问题,为高频考点,侧重考查学生的分析能力和计算能力,涉及考查学生对速率概念与计算,平衡常数概念与计算,平衡移动等有关内容理解和掌握程度,题目难度中等,注意C选项中的规律利用.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 乙醇的结构简式为C2H6O | |
| B. | C3H6Cl2有5种同分异构体 | |
| C. | 乙酸溶于水可以电离,属于离子化合物 | |
| D. | 由苯乙烯生成聚苯乙烯塑料属于加聚反应 |
| A. | 火山喷发 | |
| B. | 自然界中游离态硫缓慢氧化 | |
| C. | 煤、石油等含硫燃料的大量燃烧、硫矿石的冶炼及硫酸工业等产生的工业废气 | |
| D. | 汽车尾气 |
| A. | 液氯和氯水都含有氯离子 | |
| B. | 氯气和液氯都能使干燥的有色布条褪色 | |
| C. | 盐酸和氯水都含有氯离子 | |
| D. | 盐酸和氯水都能使湿润的有色布条褪色 |
| A. | 某温度下,pH=7的NH4Cl与NH3•H2O的混合溶液:c(NH4+)=c(Cl-)>c(H+)=c(OH-) | |
| B. | 0.1 mol/L Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c(HCOO-)<c(Na+) | |
| D. | 0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+) |
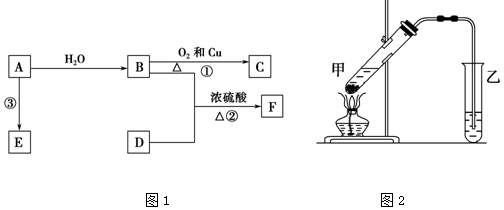
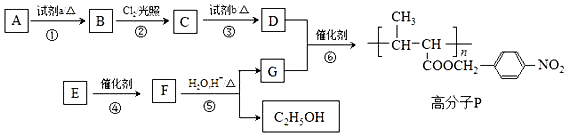
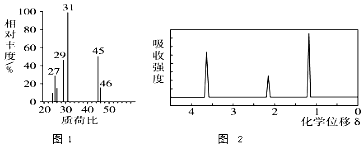
 +HO-NO2$→_{△}^{浓H_{2}SO_{4}}$
+HO-NO2$→_{△}^{浓H_{2}SO_{4}}$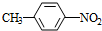 +H2O.
+H2O.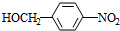 +
+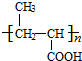 $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +nH2O.
+nH2O.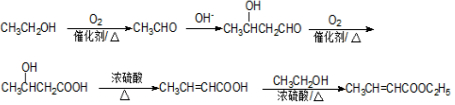 .
.