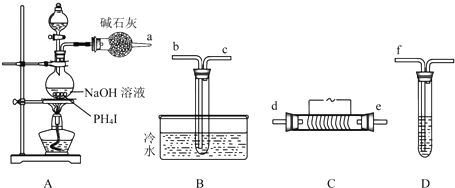
题目内容
20.短周期元素X、Y、Z、W原子序数依次增大,Y、Z、W的最高价氧化物对应水化物间可两两反应生成盐和水;化合物YWX是漂白液的有效成分.下列说法正确的是( )| A. | Z单质还原性大于Y单质 | |
| B. | X的氢化物沸点高于W的氢化物 | |
| C. | 仅含X、Y两元素的化合物均只含离子键 | |
| D. | 上述四种元素形成的简单离子中,X离子半径最小 |
分析 Y、Z、W的最高价氧化物对应水化物间可两两反应生成盐和水,说明这三种元素的最高价化合物的水化物有强酸、强碱和两性氢氧化物,Z的原子序数小于W而大于Y,所以Z是Al元素,Y为Na元素,化合物YWX是漂白液的有效成分,应为NaClO,则X为O元素,W为Cl元素,结合物质的性质分析解答.
解答 解:Y、Z、W的最高价氧化物对应水化物间可两两反应生成盐和水,说明这三种元素的最高价化合物的水化物有强酸、强碱和两性氢氧化物,Z的原子序数小于W而大于Y,所以Z是Al元素,Y为Na元素,化合物YWX是漂白液的有效成分,应为NaClO,则X为O元素,W为Cl元素,
A.金属性Na大于Al,Na的还原性较强,故A错误;
B.水可形成氢键,沸点较高,故B正确;
C.仅含X、Y两元素的化合物如为过氧化钠,则含有共价键,故C错误;
D.核外电子排布相同的离子,核电荷数越大离子半径越小,铝离子半径最小,故D错误.
故选B.
点评 本题考查了元素位置结构性质的关系及应用,熟悉元素周期表及原子结构是解本题关键,再结合元素周期律、物质的性质来分析解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列设计的实验方案不能达到实验目的是( )
| A. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一试管中加入2mL5%H2O2和1mLH2O,向另一试管中加入2mL 10%H2O2和1mLFeCl3溶液,观察并比较实验现象 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 |
8.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 热稳定性H2O>H2S | B. | 还原性Ⅰ->Br->Cl- | ||
| C. | 金属性 K>Na | D. | 酸性 HCl>HF |
12.下列实验操作能达到实验目的是( )
| 实验操作 | 实验目的 | |
| A | 将潮湿的NH3通过盛有无水CaCl2的干燥管 | 除去NH3中的水蒸气 |
| B | 往铁和稀硝酸反应后的溶液中滴入KSCN溶液 | 验证溶液中是否含有Fe3+ |
| C | 甲基橙作指示剂,用标准NaOH溶液滴定盐酸至红色 | 测量盐酸物质的量浓度 |
| D | 向2ml0.2mol/L的AgNO3溶液中先后滴加0.2mol/L 的NaCl溶液、KBr溶液各5滴 | 确定AgCl、AgBr的Kap的相对大小 |
| A. | A | B. | B | C. | C | D. | D |
10.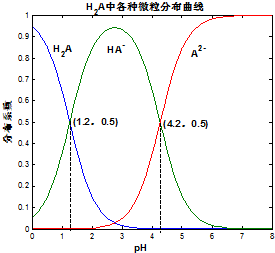 常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
 常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )| A. | H2A?2H++A2- K=10-5.4 | |
| B. | 在 0.1mol/L NaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 已知25℃时HF的 Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液中,发生的反应为:H2A+F-═HF+HA- | |
| D. | 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2 |
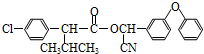 )
)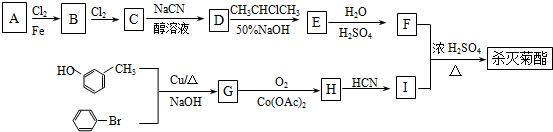
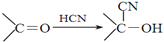
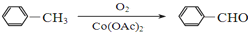
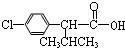 +
+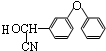 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$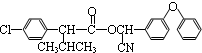 +H2O.
+H2O.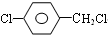 +3NaOH$→_{△}^{H_{2}O}$2NaCl+H2O+
+3NaOH$→_{△}^{H_{2}O}$2NaCl+H2O+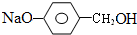 .
.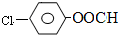 结构,则符合此条件的F共有8种.
结构,则符合此条件的F共有8种.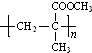 (用合成路线流程图表示,并注明反应条件).
(用合成路线流程图表示,并注明反应条件).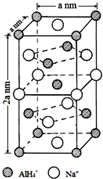 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. (标明配位键).
(标明配位键).