题目内容
5.图甲表示的是H2O2分解反应过程中的能量变化.在不同温度下,分别向H2O2溶液(20g•L-1)中加入相同体积且物质的量浓度均为0.5mol•L-1的不同溶液,反应中H2O2浓度随时间的变化如图乙所示.从图中得出的结论不正确的是( )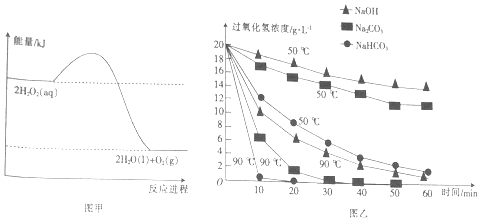
| A. | H2O2的分解反应为放热反应 | |
| B. | 断裂共价键所需的能量:2×E(O-O)<1×E(O=O) | |
| C. | 加入相同物质时,温度越高,H2O2分解的速率越快 | |
| D. | 相同温度下,加入不同物质的溶液,碱性越强,H2O2分解的速率越快 |
分析 A.由图形可知,反应物总能量大于生成物总能量;
B.H2O2分解反应属于放热反应,注意断裂化学键吸收能量,形成化学键放出能量;
C.升高温度,可加快反应速率.
D.可根据曲线斜率变化判断.
解答 解:A.由图形可知,反应物总能量大于生成物总能量,则为放热反应,故A正确;
B.H2O2分解反应属于放热反应,注意断裂化学键吸收能量,形成化学键放出能量,反应物、生成物含有相同的O-H,则2×E(O-O)<1×E(O=O),故B正确;
C.升高温度,可加快反应速率,故C正确;
D.由图象可知在90℃时一定时间之内,碳酸氢钠的斜率较大,则反应较快,故D错误;
故选D.
点评 本题综合考查化学平衡的影响以及反应热与焓变,为高频考点,侧重于学生的分析能力的考查,注意把握图象曲线的变化,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列离子方程式正确的是( )
| A. | FeCl2溶液中滴加氯水Fe2++Cl2═Fe3++2C1- | |
| B. | NaHCO3溶液水解:HCO3-+H2O?CO32-+H3O+ | |
| C. | 等体积、等浓度的稀氢氧化钡溶液与稀碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O | |
| D. | 少量CO2通人苯酚钠溶液中:2C6H5O-+CO2+H2O═2C6H5OH+CO32- |
20.在密闭容器中进行反应:X(g)+3Y(g)?2Z(g),下列说法正确的是( )
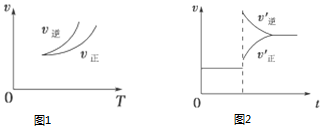

| A. | 图1说明正反应为吸热反应 | |
| B. | 反应达平衡后,增大压强气体密度将减小 | |
| C. | 图2可表示升高温度使平衡向逆反应方向移动 | |
| D. | 图2虚线可表示使用催化剂后引发的反应速率变化 |
10.下列关于反应速率的说法中,不正确的是( )
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素有浓度、压强、温度和催化剂 | |
| C. | 可逆反应达到化学平衡时,正、逆反应的速率都不为0 | |
| D. | 增大反应物浓度、提高反应温度都能增大反应速率 |
17.某无色气体可能由CH4、NO2、NH3、H2、CO、CO2和HCl中的几种气体混合而成.在恒温恒压下,将此混合气体通过过量的澄清石灰水,未见石灰水变浑浊,但混合气体的总体积减小;将剩余气体导出后,在氧气中能点燃,燃烧产物不能使无水CuSO4粉末变蓝色,则原混合气体( )
| A. | 一定不含CH4和H2,可能含有NO2和NH3 | |
| B. | 一定含有CO,可能含HCl和CO2 | |
| C. | 只含有CO和HCl | |
| D. | 一定含CO和HCl,可能含CO2 |
6. 尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示.
A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2) (填“>”、“<”或“=”);
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
①关于上述反应的焓变、熵变说法正确的是A.
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.

 尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示.
A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2) (填“>”、“<”或“=”);
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.

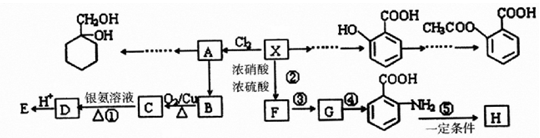
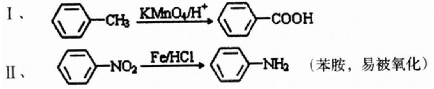
 ;
;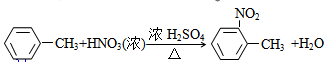 ;
;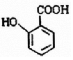 有多种同分异构体,写出符合下列条件的所有结构简式:
有多种同分异构体,写出符合下列条件的所有结构简式: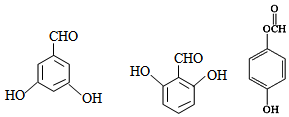 ;
;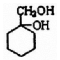 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)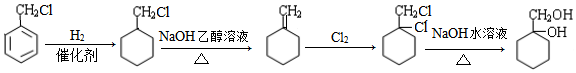 .
.