题目内容
1.下列事实不能用平衡移动原理解释的是( )| A. |  开启啤酒 | B. |  双氧水中加入氯化铁 | ||
| C. |  合成氨时增压 | D. |  NO2置于热水和冰水中 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.存在平衡H2CO3?H2O+CO2,打开瓶盖时,压强减小,平衡向右移动,二氧化碳气体溶解度减小,逸出二氧化碳,可以用平衡移动原理来解释,故A不选;
B、催化剂能加快反应速率,但不能使平衡移动,故不能用平衡移动原理解释,故B选;
C、氮气与氢气合成氨气的反应中,增大压强,化学平衡向着气体体积减小的正反应方向进行,是用勒夏特列原理解释的,故C不选;
D、烧瓶内的气体存在平衡:2NO2(g)(红棕色)?N2O4(g)(无色)△H<0,升高温度平衡向逆反应移动,NO2浓度增大,颜色变深,是用勒夏特列原理解释的,故D不选;
故选B.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且符合平衡移动的原理.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
15.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 某新型航天服材料主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 | |
| B. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 医用酒精是利用了乙醇的氧化性来杀菌消毒的 |
12.常温下PH=2的一元强酸HA溶液中加入一定体积PH=12一元弱碱MOH后恰好完全反应,下列判断一定正确的是(不考虑密度因素)( )
| A. | 加入的碱溶液体积大 | B. | 酸和碱溶液体积相等 | ||
| C. | 加入的碱溶液体积小 | D. | 以上情况都有可能 |
9.下列有关物质除杂的方法中可行的是( )
| A. | 除去石英中混有的少量铝粉,可加入氢氧化钠溶液溶解后过滤 | |
| B. | 向含少量FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取,以除去FeCl2溶液中的FeBr2 | |
| C. | 除去乙酸乙酯中混有的少量乙酸,加入饱和氢氧化钠溶液振荡后分液 | |
| D. | 除去CuCl2溶液中混有的少量FeCl3,可向溶液中加入CuO后再过滤 |
16.活性氧化锌是一种多功能性的新型无机材料,其颗粒大小在1~100nm,利用某工业废液(含有ZnO、FeO、FeO2、CuO、MnO)制备超细活性氧化锌的工艺流程如图所示.
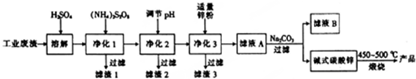
有关氢氧化物开始沉淀和完全沉淀的pH如表.
回答下列问题:
(1)净化1的目的之一是将Mn2+转化为MnO2而除去,此过程中(NH4)2SrO2作氧化剂(填“氧化剂”会“还原剂”),已知该反应中Sr${O}_{4}^{2-}$会转化为${SO}_{4}^{2-}$,若反应生成1molMnO2,则会消耗1mol (NH4)2SrO2.
(2)滤渣2的主要成分有两种,分别为Fe(OH)3和Al(OH)3,滤液B的溶质主要为Na2SO4.(填化学式).
(3)净化2应调节溶液pH的范围是5.2~5.4,调节pH可选用的试剂为ad(填字母).
a.ZnO b.CaO c.CaCO3 d.ZnCO3
(4)碱式碳酸锌在煅烧前需要洗涤烘干,检验碱式碳酸锌是否洗涤干净的操作方法是取少许最后一次洗涤液于试管中,滴加硝酸钡溶液,若无白色沉淀生成,则洗涤干净,否则未洗涤干净.
(5)煅烧碱式碳酸锌【ZnCO3•2Zn(OH)2•H2O】的化学方程式为ZnCO3•2Zn(OH)•2H2O$\frac{\underline{\;450~500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.

有关氢氧化物开始沉淀和完全沉淀的pH如表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.7 | 7.5 | 5.4 | 4.0 | 6.4 |
| 完全沉淀时的pH | 3.7 | 9.5 | 6.6 | 5.2 | 8.0 |
(1)净化1的目的之一是将Mn2+转化为MnO2而除去,此过程中(NH4)2SrO2作氧化剂(填“氧化剂”会“还原剂”),已知该反应中Sr${O}_{4}^{2-}$会转化为${SO}_{4}^{2-}$,若反应生成1molMnO2,则会消耗1mol (NH4)2SrO2.
(2)滤渣2的主要成分有两种,分别为Fe(OH)3和Al(OH)3,滤液B的溶质主要为Na2SO4.(填化学式).
(3)净化2应调节溶液pH的范围是5.2~5.4,调节pH可选用的试剂为ad(填字母).
a.ZnO b.CaO c.CaCO3 d.ZnCO3
(4)碱式碳酸锌在煅烧前需要洗涤烘干,检验碱式碳酸锌是否洗涤干净的操作方法是取少许最后一次洗涤液于试管中,滴加硝酸钡溶液,若无白色沉淀生成,则洗涤干净,否则未洗涤干净.
(5)煅烧碱式碳酸锌【ZnCO3•2Zn(OH)2•H2O】的化学方程式为ZnCO3•2Zn(OH)•2H2O$\frac{\underline{\;450~500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
6.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的是( )
| A. | Na2O2固体(稀硫酸) | B. | FeCl2溶液(KSCN溶液) | ||
| C. | KI固体(淀粉溶液) | D. | NaOH溶液(盐酸) |
13.某科研小组设计出利用工业废酸(l0%)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,如图所示.
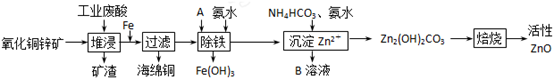
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”“<”或“=”).
(2)物质A可使用下列物质中的BC.
A.KMnO4 B.O2 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂--K2FeO4,写出该反应的离子方程式2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O.

已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”“<”或“=”).
(2)物质A可使用下列物质中的BC.
A.KMnO4 B.O2 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂--K2FeO4,写出该反应的离子方程式2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O.
10.将0.2mol AgNO3、0.4mol Cu(NO3)2、0.6mol KCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3mol Cu,此时在另一极上产生的气体体积(标准状况)为( )
| A. | 3.36 L | B. | 4.48 L | C. | 5.6 L | D. | 6.72 L |
11.120℃时,0.1mol两种气态烃组成的混合气体完全燃烧后得到8.8gCO2和3.6g水,则这两种烃可能是下列的( )
| A. | CH4和C3H6 | B. | C2H4和C2H6 | C. | CH4和C3H4 | D. | CH4和C2H4 |