题目内容
10.将0.2mol AgNO3、0.4mol Cu(NO3)2、0.6mol KCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3mol Cu,此时在另一极上产生的气体体积(标准状况)为( )| A. | 3.36 L | B. | 4.48 L | C. | 5.6 L | D. | 6.72 L |
分析 混合溶液中发生的反应为AgNO3+KCl=AgCl+KNO3,根据方程式知,0.2molAgNO3完全反应需要0.2molKCl,还剩余0.4molKCl,且同时生成0.2molKNO3,所以混合后溶液中的溶质为0.2mol KNO3、0.4mol Cu(NO3)2、0.4mol KCl,用惰性电极电解一段时间后,若在一极析出Cu0.3mol<0.4mol,根据Cu和转移电子之间的关系式知,转移电子的物质的量=2n(Cu)=2×0.3mol=0.6mol,氯离子完全放电时转移电子物质的量=0.4mol×1=0.4mol,则还有0.2mol电子转移时生成氧气,则生成n(O2)=$\frac{0.2mol}{4}$=0.05mol,生成n(Cl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.4mol=0.2mol,再根据V=nVm计算气体体积.
解答 解:混合溶液中发生的反应为AgNO3+KCl=AgCl+KNO3,根据方程式知,0.2molAgNO3完全反应需要0.2molKCl,还剩余0.4molKCl,且同时生成0.2molKNO3,所以混合后溶液中的溶质为0.2mol KNO3、0.4mol Cu(NO3)2、0.4mol KCl,用惰性电极电解一段时间后,若在一极析出Cu0.3mol<0.4mol,根据Cu和转移电子之间的关系式知,转移电子的物质的量=2n(Cu)=2×0.3mol=0.6mol,氯离子完全放电时转移电子物质的量=0.4mol×1=0.4mol,则还有0.2mol电子转移时生成氧气,则生成n(O2)=$\frac{0.2mol}{4}$=0.05mol,生成n(Cl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.4mol=0.2mol,生成气体V=nVm=(0.2+0.05)mol×22.4L/mol=5.6L,
故选C.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断及计算能力,明确离子共存条件、电解时溶液中溶质成分及其物质的量是解本题关键,注意氯离子和银离子的反应,为易错题.

| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、S2-、Cl- | ||
| C. | K+、NH4+、MnO4-、SO42- | D. | Na+、K+、NO3-、HCO3- |
| A. |  开启啤酒 | B. |  双氧水中加入氯化铁 | ||
| C. |  合成氨时增压 | D. |  NO2置于热水和冰水中 |
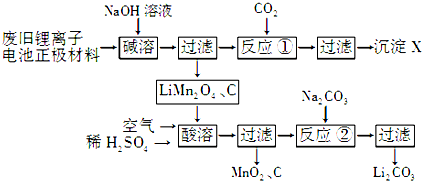
(1)X的化学式为Al(OH)3.
(2)写出“酸溶”过程中反应的离子方程式:4LiMn2O4+O2+4H+═4Li++8MnO2+2H2O.
(3)反应②中与Na2CO3反应的物质有Li2SO4和H2SO4(填化学式);工业上洗涤Li2CO3用的是热水而不是冷水,其原因是降低Li2CO3的溶解度,减少溶解.
(4)固相法制备LiMn2O4的实验过程如下:将MnO2和Li2CO3按4:1的物质的量之比配料,球磨3~5小时,然后升温,高温加热,保温24小时,冷却至室温.
①写出该反应的化学方程式:8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.
②LiMn2O4中锰元素的平均价态为+3.5.在不同温度下,合成的LiMn2O4中Mn2+、Mn3+和Mn4+的含量与温度的关系见下表.
| T/℃ | w(Mn2+)(%) | w(Mn3+)(%) | w(Mn4+)(%) |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |
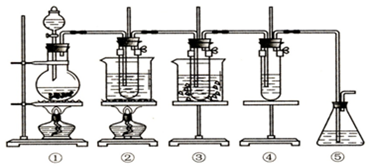
| A. | 体积:④<①<③<② | B. | 质量:④<①<③<② | ||
| C. | 物质的量:①<②<③<④ | D. | 氢原子数:②<④<③<① |

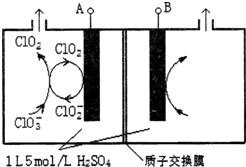 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.