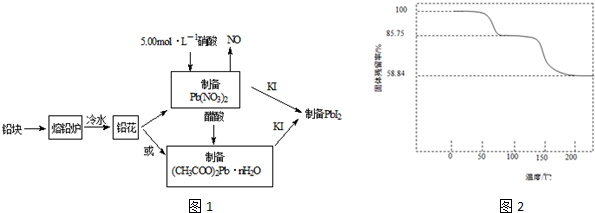
题目内容
13.某科研小组设计出利用工业废酸(l0%)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,如图所示.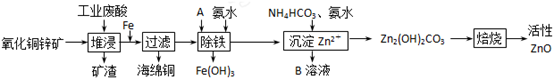
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”“<”或“=”).
(2)物质A可使用下列物质中的BC.
A.KMnO4 B.O2 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂--K2FeO4,写出该反应的离子方程式2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O.
分析 氧化铜锌矿先用稀硫酸溶解,然后向所得溶液中加入铁粉将铜置换出来,加氧化剂A将Fe2+氧化成Fe3+,加氨水调节溶液的PH,将其除去,再用碳酸氢铵洗涤溶液,得到溶解度较小的碱式碳酸锌,最后焙烧得到氧化锌,
(1)相同条件下,溶解度大的物质先溶解;
(2)考虑除杂过程不引入新的杂质;
(3)PH的范围应是使铁沉淀完全而锌不沉淀;
(4)结合题给信息利用工业废酸和氮肥考虑;
(5)从题给信息写出反应物和生成物,配平即可.
解答 解:(1)相同条件下,溶解度大的物质先溶解,因在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)<Ksp(ZnS),故答案为:<;
(2)除铁过程中加入A和氨水,使亚铁离子变成氢氧化铁沉淀,故A应为氧化剂,考虑不引入新的杂质,应选BC,故答案为:BC;
(3)从图表数据可知,铁离子沉淀完全的PH为3.2,锌离子开始沉淀的PH为6.2,则除铁PH范围为:3.2~6.2,故答案为:3.2~6.2;
(4)因所用废酸为硫酸,B又可作氮肥,所以B为NH4)2SO4,故答案为:(NH4)2SO4;
(5)由题给信息可知,反应物为2Fe(OH)3、ClO-、OH-,生成物之一为FeO42-,因铁在反应中化合价升高,故氯的化合价降低,故另一产物为Cl-,根据元素守恒,还有水是产物.根据化合价升降法配平此方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
点评 本题属于工艺流程图方面题目,要搞清实验目的和题给信息,结合流程和题目设问正确解题,本题难度中等.

练习册系列答案
相关题目
7.下列变化与氧化还原反应无关的是( )
| A. | 铁制品生锈 | B. | 食品腐烂变质 | ||
| C. | 氧化亚铁溶于硝酸 | D. | K2CrO4溶液中滴加硫酸 |
4.市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平离子方程式(将化学计量数填于空白处)
1IO3-+5I-+6H+=3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;b.加入适量Na2SO3稀溶液;c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位是在步骤b后,增加操作;
所缺步骤为将分液漏斗充分振荡后静置
(3)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4mol•L-1的Na2S2O3溶液20.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴入最后一滴溶液时,溶液的蓝色恰好消失,且半分钟内不恢复原色,则达到滴定终点.
②根据以上实验和包装袋说明,所测精制盐的碘含量是20 mg/kg.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
1IO3-+5I-+6H+=3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;b.加入适量Na2SO3稀溶液;c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位是在步骤b后,增加操作;
所缺步骤为将分液漏斗充分振荡后静置
(3)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4mol•L-1的Na2S2O3溶液20.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴入最后一滴溶液时,溶液的蓝色恰好消失,且半分钟内不恢复原色,则达到滴定终点.
②根据以上实验和包装袋说明,所测精制盐的碘含量是20 mg/kg.
1.下列事实不能用平衡移动原理解释的是( )
| A. |  开启啤酒 | B. |  双氧水中加入氯化铁 | ||
| C. |  合成氨时增压 | D. |  NO2置于热水和冰水中 |
5.锰酸锂(LiMn2O4)是新一代锂离子电池的正极材料.实验室回收利用废旧锂离子电池正极材料(锰酸锂、碳粉等涂覆在铝箔上)的一种流程如下:
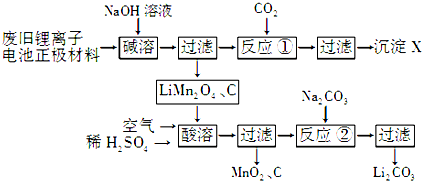
(1)X的化学式为Al(OH)3.
(2)写出“酸溶”过程中反应的离子方程式:4LiMn2O4+O2+4H+═4Li++8MnO2+2H2O.
(3)反应②中与Na2CO3反应的物质有Li2SO4和H2SO4(填化学式);工业上洗涤Li2CO3用的是热水而不是冷水,其原因是降低Li2CO3的溶解度,减少溶解.
(4)固相法制备LiMn2O4的实验过程如下:将MnO2和Li2CO3按4:1的物质的量之比配料,球磨3~5小时,然后升温,高温加热,保温24小时,冷却至室温.
①写出该反应的化学方程式:8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.
②LiMn2O4中锰元素的平均价态为+3.5.在不同温度下,合成的LiMn2O4中Mn2+、Mn3+和Mn4+的含量与温度的关系见下表.
由此可以确定:在上述温度范围内,锰元素的平均价态的变化趋势是先变大,后变小.

(1)X的化学式为Al(OH)3.
(2)写出“酸溶”过程中反应的离子方程式:4LiMn2O4+O2+4H+═4Li++8MnO2+2H2O.
(3)反应②中与Na2CO3反应的物质有Li2SO4和H2SO4(填化学式);工业上洗涤Li2CO3用的是热水而不是冷水,其原因是降低Li2CO3的溶解度,减少溶解.
(4)固相法制备LiMn2O4的实验过程如下:将MnO2和Li2CO3按4:1的物质的量之比配料,球磨3~5小时,然后升温,高温加热,保温24小时,冷却至室温.
①写出该反应的化学方程式:8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.
②LiMn2O4中锰元素的平均价态为+3.5.在不同温度下,合成的LiMn2O4中Mn2+、Mn3+和Mn4+的含量与温度的关系见下表.
| T/℃ | w(Mn2+)(%) | w(Mn3+)(%) | w(Mn4+)(%) |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |