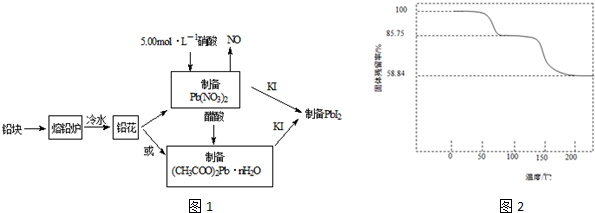
题目内容
16.活性氧化锌是一种多功能性的新型无机材料,其颗粒大小在1~100nm,利用某工业废液(含有ZnO、FeO、FeO2、CuO、MnO)制备超细活性氧化锌的工艺流程如图所示.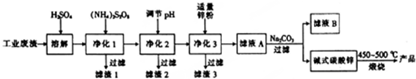
有关氢氧化物开始沉淀和完全沉淀的pH如表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.7 | 7.5 | 5.4 | 4.0 | 6.4 |
| 完全沉淀时的pH | 3.7 | 9.5 | 6.6 | 5.2 | 8.0 |
(1)净化1的目的之一是将Mn2+转化为MnO2而除去,此过程中(NH4)2SrO2作氧化剂(填“氧化剂”会“还原剂”),已知该反应中Sr${O}_{4}^{2-}$会转化为${SO}_{4}^{2-}$,若反应生成1molMnO2,则会消耗1mol (NH4)2SrO2.
(2)滤渣2的主要成分有两种,分别为Fe(OH)3和Al(OH)3,滤液B的溶质主要为Na2SO4.(填化学式).
(3)净化2应调节溶液pH的范围是5.2~5.4,调节pH可选用的试剂为ad(填字母).
a.ZnO b.CaO c.CaCO3 d.ZnCO3
(4)碱式碳酸锌在煅烧前需要洗涤烘干,检验碱式碳酸锌是否洗涤干净的操作方法是取少许最后一次洗涤液于试管中,滴加硝酸钡溶液,若无白色沉淀生成,则洗涤干净,否则未洗涤干净.
(5)煅烧碱式碳酸锌【ZnCO3•2Zn(OH)2•H2O】的化学方程式为ZnCO3•2Zn(OH)•2H2O$\frac{\underline{\;450~500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
分析 由利用某工业废液(含有ZnO、FeO、FeO2、CuO、MnO)制备超细活性氧化锌的工艺流程如图可知,用稀硫酸溶解含锌废料,并过滤除杂,得到滤液中含锌离子,与加入的Na2CO3溶液反应生成碱式碳酸锌,最后焙解获得活性氧化锌.
(1)净化1是利用(NH4)2S2O7将Mn2+氧化化为MnO2而除去,此过程中(NH4)2S2O7中Sr从+7价降低为+6价,氧化Mn2+生成1molMnO2需要转移2mol电子,结合电子守恒可判断反应物(NH4)2S2O7消耗的物质的量;
(2)经过净化1后滤液中只含有Fe3+、Al3+、Zn2+、Cu2+,净化2调节溶液pH的目的是为了促进水解Fe3+、Al3+生成沉淀,并通过过滤除去;净化3用过量锌是为了除去溶液里的Cu2+,过滤得到的滤液A中主要剩下Na+、SO42-、Zn2+,滴加Na2CO3生成碱式碳酸锌,过滤后滤液B中应该主要是Na+、SO42-;
(3)净化2的目的是为了调节溶解的pH促进溶液里Fe3+、Al3+生成沉淀,同时防止Zn2+、Cu2+水解转化为沉淀,可结合这四种离子完全沉淀时溶液的pH判断控制范围;调节pH可选用的试剂以不引入新的杂质离子为宜;
(4)最初洗涤液里含有SO42-,完全洗净后洗涤液里则不再有SO42-,可通过实验检验是否存在SO42-来证明洗涤是否干净;
(5)在450℃左右高温煅烧碱式碳酸锌【ZnCO3•2Zn(OH)2•H2O】得到的产物为ZnO、CO2及水,可根据原子守恒书写并配平化学方程式.
解答 解:由利用某工业废液(含有ZnO、FeO、FeO2、CuO、MnO)制备超细活性氧化锌的工艺流程如图可知,用稀硫酸溶解含锌废料,并过滤除杂,得到滤液中含锌离子,与加入的Na2CO3溶液反应生成碱式碳酸锌,最后焙解获得活性氧化锌.
(1)净化1过程中将Mn2+氧化化为MnO2,可知(NH4)2S2O7为氧化剂,氧化Mn2+生成1molMnO2需要转移2mol电子,而S从+7价还原为+6价,消耗(NH4)2S2O7的物质的量为$\frac{2mol}{2}$=1mol,故答案为:氧化剂;1;
(2)净化2通过调节溶液pH使Fe3+、Al3+水解生成沉淀Fe(OH)3、Al(OH)3,过滤后的滤渣2的成分即为Fe(OH)3、Al(OH)3;滤液A中主要剩下Na+、SO42-、Zn2+,则生成碱式碳酸锌后滤液B中应该主要是Na+、SO42-,溶质B的成分为Na2SO4,
故答案为:Fe(OH)3;Al(OH)3;Na2SO4;
(3)根据相关氢氧化物开始沉淀和完全沉淀的pH表可知,当溶液的PH为5.2~5.4时Fe3+、Al3+水解完全,而Cu2+及Zn2+尚未沉淀;根据除杂原则,选择ZnO或ZnCO3调节溶液pH,故答案为:5.2~5.4;ad;
(4)欲检验沉淀洗涤是否干净,可取少许最后一次洗涤液于试管中,滴加硝酸钡溶液,若无白色沉淀生成,则洗涤干净,否则未洗涤干净,故答案为:取少许最后一次洗涤液于试管中,滴加硝酸钡溶液,若无白色沉淀生成,则洗涤干净,否则未洗涤干净;
(5“煅烧”反应生成ZnO、二氧化碳和水,反应为ZnCO3•2Zn(OH)•2H2O$\frac{\underline{\;450~500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑,故答案为:ZnCO3•2Zn(OH)•2H2O$\frac{\underline{\;450~500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
点评 本题考查学生对工艺流程的理解、阅读获取信息能力、对操作步骤的分析评价、物质的分离提纯、氧化还原反应计算等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力,题目难度中等.

 优学名师名题系列答案
优学名师名题系列答案| A. | 6 | B. | 9 | C. | 12 | D. | 18 |
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
1IO3-+5I-+6H+=3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;b.加入适量Na2SO3稀溶液;c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位是在步骤b后,增加操作;
所缺步骤为将分液漏斗充分振荡后静置
(3)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4mol•L-1的Na2S2O3溶液20.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴入最后一滴溶液时,溶液的蓝色恰好消失,且半分钟内不恢复原色,则达到滴定终点.
②根据以上实验和包装袋说明,所测精制盐的碘含量是20 mg/kg.
| A. |  开启啤酒 | B. |  双氧水中加入氯化铁 | ||
| C. |  合成氨时增压 | D. |  NO2置于热水和冰水中 |
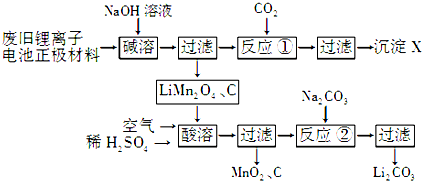
(1)X的化学式为Al(OH)3.
(2)写出“酸溶”过程中反应的离子方程式:4LiMn2O4+O2+4H+═4Li++8MnO2+2H2O.
(3)反应②中与Na2CO3反应的物质有Li2SO4和H2SO4(填化学式);工业上洗涤Li2CO3用的是热水而不是冷水,其原因是降低Li2CO3的溶解度,减少溶解.
(4)固相法制备LiMn2O4的实验过程如下:将MnO2和Li2CO3按4:1的物质的量之比配料,球磨3~5小时,然后升温,高温加热,保温24小时,冷却至室温.
①写出该反应的化学方程式:8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.
②LiMn2O4中锰元素的平均价态为+3.5.在不同温度下,合成的LiMn2O4中Mn2+、Mn3+和Mn4+的含量与温度的关系见下表.
| T/℃ | w(Mn2+)(%) | w(Mn3+)(%) | w(Mn4+)(%) |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |
| A. | 金刚石与石墨互为同素异形体 | B. | H、D、T互为同位素 | ||
| C. | CH3-CH3与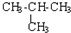 互为同系物 互为同系物 | D. | 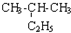 与 与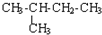 互为同分异构体 互为同分异构体 |
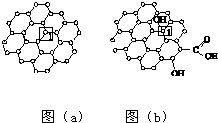 石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].