题目内容
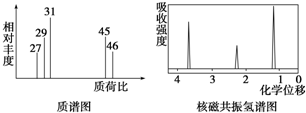
15.0.1mol某烃在足量的氧气中完全燃烧,生成标准状况下11.2LCO2和10.8g水,则该烃的分子式为C5H12.请写出其结构简式:①CH3-CH2-CH2-CH2-CH3② ③
③ .
.
分析 计算水、二氧化碳的物质的量,根据原子守恒确定烃的分子式,由分子式确定烃的种类,结合碳链异构确定同分异构体的种类,以此解答该题.
解答 解:10.8g H2O的物质的量为$\frac{10.8g}{18g/mol}$=0.6mol,11.2LCO2(标准状况下)的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,则有机物分子中N(C)=$\frac{0.5mol}{0.1mol}$=5、N(H)=$\frac{0.6mol×2}{0.1mol}$=12,故该烃的分子式为C5H12,对应的同分异构体有CH3-CH2-CH2-CH2-CH3、 、
、 ,
,
故答案为:C5H12;CH3-CH2-CH2-CH2-CH3; ;
; .
.
点评 本题考查烃燃烧有关计算、有机物分子式确定、同分异构体书写,侧重于考查的分析、计算能力的考查,难度不大,注意掌握有机物燃烧有关规律.

练习册系列答案
相关题目
3.某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+.为确认溶液组成进行如下实验:(1)向200ml上述溶液中加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).由此可以得出关于原溶液组成的正确结论是( )
| A. | c(CO32-)=0.01mol•L-1,c(NH4+)<c(SO42-) | |
| B. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ | |
| D. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
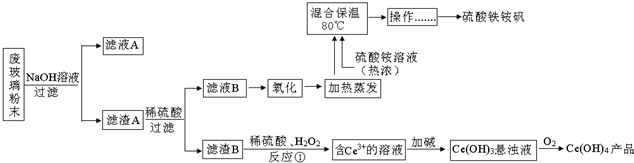
4.MnO2和锌是制造锌锰电池的主要原料,一种新工艺采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为原料生产MnO2和锌,其简化工艺流程如下(中间产物的固体部分已经略去):
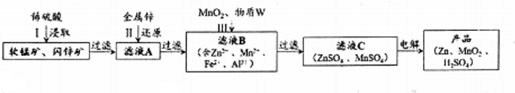
已知:
①浸取时发生的主要反应为:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,杂质FeS、CuS、CdS也会发生类似反应.
②某些金属离子完全沉淀的pH如下表:
请回答下列问题:
(1)步骤Ⅰ中浸取时Al2O3与稀硫酸反应的化学方程式为Al2O3+3H2SO4═Al2(SO4)3+3H2O.
(2)步骤Ⅱ中还原回收得到的金属单质是Cu、Cd.
(3)步骤Ⅲ中MnO2的作用是将Fe2+氧化成Fe3+,适宜选作物质W的试剂为BD(选填编号).
A.NaOH B.ZnO C.NH3•H2O D.MnCO3
(4)酸性锌锰干电池放电时,负极的电极反应式为Zn-2e-═Zn2+.
(5)MnSO4可用于制备MnCO3,MnCO3在空气中加热反应也可制得MnO2.
已知25℃,101kPa时:
Mn(s)+O2(g)=MnO2(s)△H1=-520kJ•mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ•mol-1
2Mn(s)+2C(s)+3O2(g)=2MnCO3(s)△H3=-894kJ•mol-1
MnCO3在空气中加热反应生成MnO2的热化学方程式为2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=-933kJ•mol-1.
(6)按照图示流程,若某次生产过程中使用了100t闪锌矿,其中ZnS含量为80%,浸取时ZnS的损失率为3%,最终得到87t MnO2.假设流程中每个步骤都反应完全,电解(使用惰性电极)时无其他产物生成,则流程中除杂质所引入的锌元素的质量为13t.

已知:
①浸取时发生的主要反应为:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,杂质FeS、CuS、CdS也会发生类似反应.
②某些金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤Ⅰ中浸取时Al2O3与稀硫酸反应的化学方程式为Al2O3+3H2SO4═Al2(SO4)3+3H2O.
(2)步骤Ⅱ中还原回收得到的金属单质是Cu、Cd.
(3)步骤Ⅲ中MnO2的作用是将Fe2+氧化成Fe3+,适宜选作物质W的试剂为BD(选填编号).
A.NaOH B.ZnO C.NH3•H2O D.MnCO3
(4)酸性锌锰干电池放电时,负极的电极反应式为Zn-2e-═Zn2+.
(5)MnSO4可用于制备MnCO3,MnCO3在空气中加热反应也可制得MnO2.
已知25℃,101kPa时:
Mn(s)+O2(g)=MnO2(s)△H1=-520kJ•mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ•mol-1
2Mn(s)+2C(s)+3O2(g)=2MnCO3(s)△H3=-894kJ•mol-1
MnCO3在空气中加热反应生成MnO2的热化学方程式为2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=-933kJ•mol-1.
(6)按照图示流程,若某次生产过程中使用了100t闪锌矿,其中ZnS含量为80%,浸取时ZnS的损失率为3%,最终得到87t MnO2.假设流程中每个步骤都反应完全,电解(使用惰性电极)时无其他产物生成,则流程中除杂质所引入的锌元素的质量为13t.
5.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| B. | 一定量的浓硫酸与Xg Zn反应,若转移的电子为0.4 mol,则参加反应的硫酸分子数目一定等于0.4NA | |
| C. | 高温下,16.8g Fe与足量水蒸气反应,转移的电子数为0.7NA | |
| D. | 向含有0.2 mol FeCl3的两份溶液中分别滴加过量Na2S、通入过量H2S气体,则产生的沉淀比为:$\frac{0.3{N}_{A}}{0.1{N}_{A}}$ |

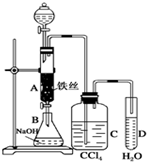 某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中. .
.