题目内容
12.硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等.(1)用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:

稀硫酸、铜和氧化铁反应过程中属于氧化还原反应的离子方程式是Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+;向混合溶液中通入热空气的反应的离子方程式是4Fe2++4H++O2═4Fe3++2H2O;由滤液得到无水硫酸铜的实验操作是蒸发结晶、加热脱水.
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵.主要的工艺流程如下图所示:

①吸收塔中发生反应的化学方程式是4NH3•H2O+2SO2+O2=2(NH4)2SO4+2H2O.
②有数据表明,吸收塔中溶液的pH在5.5-6.0之间,生产效率较高.当控制一定流量的尾气时,调节溶液的pH的方法是调节氨水的流量或用量.
分析 (1)依据流程图分析判断,稀硫酸、铜和氧化铁反应是氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成氯化亚铁和氯化铜;通入热的空气是为了氧化亚铁离子为三价铁离子,调整溶液PH除去铁离子;溶液中得到溶质固体的方法是蒸发水结晶析出;
(2)①吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵,吸收塔中通入空气是利用氧气氧化二氧化硫为硫酸盐;
②吸收塔中溶液的pH在5.5~6.0之间,生产效率较高.当控制一定流量的尾气时,调节溶液的pH的方法是控制氨气的流量.
解答 解:(1)依据流程转化图分析,铜需要硫酸和氧化铁反应生成的铁离子溶解生成铜离子,再通入空气氧化亚铁离子为铁离子,调节溶液PH使铁离子沉淀除去,得到硫酸铜溶液;加热蒸发浓缩结晶得到硫酸铜晶体;反应的离子方程式为:Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+(或Fe2O3+Cu+6H+═3H2O+2Fe2++Cu2+);通入空气的作用是氧气氧化亚铁离子为铁离子的反应,反应离子方程式为:4Fe2++4H++O2═4Fe3++2H2O;得到硫酸铜溶液加热蒸发得到硫酸铜晶体的方法为:蒸发结晶、加热脱水,
故答案为:Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+;4Fe2++4H++O2═4Fe3++2H2O;蒸发结晶、加热脱水;
(2)①依据流程图分析,吸收塔中发生反应是二氧化硫、一水合氧气反应生成硫酸铵和水,反应的化学方程式为:4NH3•H2O+2SO2+O2=2(NH4)2SO4+2H2O;
故答案为:4NH3•H2O+2SO2+O2=2(NH4)2SO4+2H2O;
②吸收塔中溶液的pH在5.5~6.0之间,生产效率较高,当控制一定流量的尾气时,可通过调节氨水的流量或用量来调节溶液的pH,
故答案为:调节氨水的流量或用量.
点评 本题考查了制备方案的设计,题目难度中等,根据制备流程明确制备原理为解答关键,注意掌握制备方案设计与评价的原则,试题培养了学生的分析能力及化学实验能力.

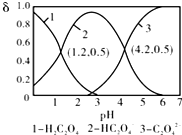
| A. | pH=1.2溶液中:c(K+)+c(H+)═c(OH-)+c(H2C2O4) | |
| B. | pH=2.7溶液中:$\frac{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}{[c({H}_{2}{C}_{2}{O}_{4)}×c({C}_{2}{{O}_{4}}^{2-})]}$=1000 | |
| C. | 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大 | |
| D. | 将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液 |
| A. | c(CO32-)=0.01mol•L-1,c(NH4+)<c(SO42-) | |
| B. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ | |
| D. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
已知:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
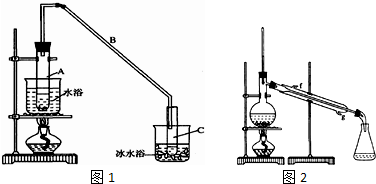
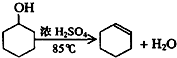
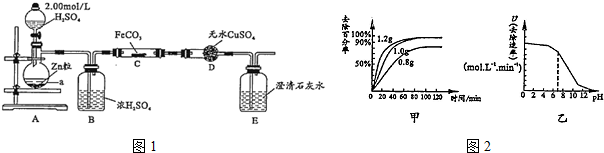
将12.5mL环己醇加入试管A中,再加入lml浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A采用水浴加热的优点是均匀受热,容易控制反应温度.
②试管C置于冰水浴中的目的是试管C置于冰水浴中.
(2)制备精品 ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用c(填字母,单选)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从g口进入(填g或f).蒸馏时要加入生石灰,目的是生石灰吸收水分,便于蒸馏出更纯净的产品.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填字母,单选).
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
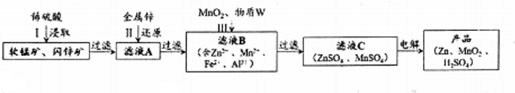
已知:
①浸取时发生的主要反应为:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,杂质FeS、CuS、CdS也会发生类似反应.
②某些金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤Ⅰ中浸取时Al2O3与稀硫酸反应的化学方程式为Al2O3+3H2SO4═Al2(SO4)3+3H2O.
(2)步骤Ⅱ中还原回收得到的金属单质是Cu、Cd.
(3)步骤Ⅲ中MnO2的作用是将Fe2+氧化成Fe3+,适宜选作物质W的试剂为BD(选填编号).
A.NaOH B.ZnO C.NH3•H2O D.MnCO3
(4)酸性锌锰干电池放电时,负极的电极反应式为Zn-2e-═Zn2+.
(5)MnSO4可用于制备MnCO3,MnCO3在空气中加热反应也可制得MnO2.
已知25℃,101kPa时:
Mn(s)+O2(g)=MnO2(s)△H1=-520kJ•mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ•mol-1
2Mn(s)+2C(s)+3O2(g)=2MnCO3(s)△H3=-894kJ•mol-1
MnCO3在空气中加热反应生成MnO2的热化学方程式为2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=-933kJ•mol-1.
(6)按照图示流程,若某次生产过程中使用了100t闪锌矿,其中ZnS含量为80%,浸取时ZnS的损失率为3%,最终得到87t MnO2.假设流程中每个步骤都反应完全,电解(使用惰性电极)时无其他产物生成,则流程中除杂质所引入的锌元素的质量为13t.
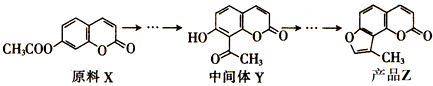
下列说法正确的是( )
| A. | X与Y互为同分异构体 | |
| B. | X与Y均不能使酸性KMnO4溶液褪色 | |
| C. | 在光照条件下,Z中的苯环能与Cl2发生取代反应 | |
| D. | Z中所有不饱和键均能与溴发生加成反应 |
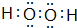 .
.